La cicatrización de heridas, tanto agudas como crónicas, implica una compleja coreografía interna y externa de señalización, además de interacciones con las células vecinas y el entorno circundante o estímulos externos, y migración celular.
Introducción
La cicatrización de heridas, tanto agudas como crónicas, implica una compleja coreografía interna y externa de señalización, además de interacciones con las células vecinas y el entorno circundante o estímulos externos, y migración celular. Esta relación sinérgica también puede variar según el tipo de herida. Por lo tanto, la caracterización de los mecanismos en el mismo es de gran interés para muchas aplicaciones, incluyendo vendaje de heridas, cicatrización de quemaduras y úlceras, eliminación de cicatrices, cosmética estética y antienvejecimiento y mucho más.
Históricamente, la mayoría de los ensayos de cicatrización de heridas utilizan una técnica de raspado, en la que una capa celular bidimensional (2D) confluente se lesiona mecánicamente y se mide la migración celular. Las principales limitaciones de este método son la falta de un entorno biomimético, una arquitectura de tipo in vivo y una red multicelular, y dado que los métodos de rascado varían, los resultados son difíciles de replicar.
Los métodos tridimensionales (3D) más nuevos permiten que las células se autoagreguen en ausencia de un sustrato sólido. Las redes vitales de comunicación célula-célula y célula-matriz extracelular (MEC) pueden restablecerse. De esta manera, tanto la morfología como el comportamiento celular se asemejan más a los que se encuentran en el cuerpo.
Aquí, demostramos un nuevo modelo de ensayo de cicatrización de heridas en 3D (Figura 1) que puede superar las limitaciones del ensayo en 2D. El método incorpora la levitación magnética en la que las células se incuban primero con un conjunto de nanopartículas magnéticas no tóxicas que consta de oro, óxido de hierro y poli-L-lisina, que magnetiza las células sin inducir una respuesta inflamatoria de citoquinas. Luego, las células se colocan en un pozo de microplacas y se levitan colocando un imán sobre el pozo. Las células se agregan y forman ECM en unas pocas horas, se retira el imán y se pipetea para romper el agregado, creando una vez más una suspensión de una sola célula.
A continuación, se transfieren los números de células apropiados a una placa de ensayo de 384 pocillos y se coloca un imán de anillo debajo de la placa, lo que permite que las células dentro de cada pocillo se modelen en una nueva forma de anillo 3D. Las tasas de cicatrización de heridas se determinan controlando el cierre del anillo una vez que se retira el imán del anillo. Se probaron dos modelos de células de fibroblastos individuales, células de fibrosarcoma HT-1080 y fibroblastos dérmicos primarios, para comparar las tasas de cicatrización de heridas entre la línea de células cancerosas y los modelos de células primarias.
También se examinaron cocultivos que contenían fibroblastos y queratinocitos para determinar si más modelos celulares similares a los in vivo tienen un efecto sobre las tasas de cicatrización de heridas. Se realizaron imágenes cinéticas automatizadas utilizando un nuevo lector multimodo de imágenes celulares para rastrear el cierre del anillo a intervalos regulares durante el período de incubación. La combinación proporciona un método robusto y fácil de usar para generar resultados precisos y repetibles del efecto que tienen las nuevas moléculas de prueba en importantes aplicaciones de cicatrización de heridas.
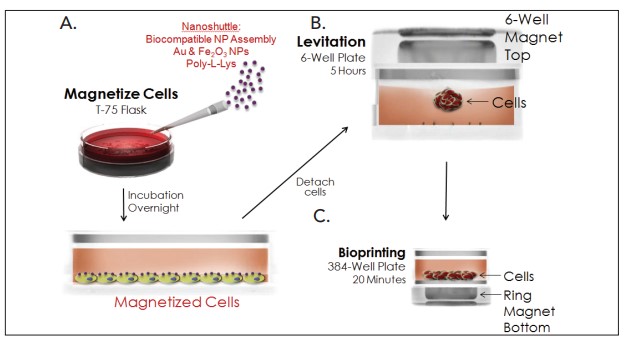
Figura 1. Protocolo del kit de ensayo BiO. El kit de ensayo BiO de 384 pocillos utiliza el ensamblaje de nanopartículas NanoShuttle-PL para (A) magnetizar las células. Después de la incubación, las células (B) se separan, se resuspenden en una placa repelente de células y se levitan magnéticamente para agregarse e inducir ECM. Luego de romper los agregados, (C) las células individuales se transfieren a una placa repelente de células de 384 pozos colocada encima de un imán de anillo de 384 pozos, donde se agregan en el fondo del pozo en forma de imán. Concluida de la agregación, la placa se retira del imán antes de colocarla en la cámara. Los anillos celulares se contraerán con el tiempo correspondiente a la tasa de curación de heridas del modelo celular y el tratamiento del pozo.
Materiales y métodos
Materiales
Componentes experimentales y de ensayo
El kit BiO Assay™ de 384 pocillos (N.º de catálogo de GBO 781846, que consta de 2 viales NanoShuttle™-PL, impulsor magnético de levitación de 6 pocillos, impulsor magnético de retención y esferoide de 384 pocillos (2), impulsores magnéticos de retención de 96 pocillos Placa de mezcla de pocillos profundos, microplacas de superficie repelente de células transparentes de 6 pocillos y 384 pocillos), unidad de anillo prototipo de 384 pocillos y superficie repelente de células adicional de 6 pocillos (n.º de catálogo GBO 657860) y μClear negra de 384 pocillos. Nano3D Biosciences, Inc., (Houston, TX) y Greiner Bio-One, Inc., (Monroe, NC) donaron generosamente microplacas (N.º de catálogo de GBO 781976).
El inhibidor conocido Citocalasina D (Nº de catálogo 1233) se adquirió de R&D Systems (Minneapolis, MN).
Células
Se obtuvieron células de fibrosarcoma HT-1080 (Nº de catálogo CCL-121) y queratinocitos inmortalizados (Nº de catálogo CRL-2309) de ATCC (Manassas, VA). Se obtuvieron RFP que expresan fibroblastos dérmicos neonatales humanos (Nº de catálogo cAP0008RFP) de Angio-Proteomie (Boston, MA).
Lector multimodo de imágenes de células Cytation™ 5
Cytation 5 es un lector de microplacas multimodo modular combinado con microscopía digital automatizada. La lectura de microplacas basada en filtro y monocromador está disponible, y el módulo de microscopía proporciona un aumento de hasta 60x en fluorescencia, campo claro, campo claro de color y contraste de fase. Con especial énfasis en los ensayos de células vivas, Cytation 5 cuenta con control de temperatura a 65 ºC, control de gas CO2/O2 e inyectores duales para ensayos cinéticos, y está controlado por el software de análisis de datos Gen5™ integrado. El instrumento realizó imágenes cinéticas de la estructura celular en 3D utilizando canales de imágenes de proteína fluorescente roja (RFP) y de campo claro, y un objetivo 2x.
Métodos
Procedimiento de ensayo
Se cultivaron matraces T-75 de cultivos celulares o cocultivos hasta una confluencia del 80 % y luego se trataron con 600 μL de NanoShuttle-PL durante la noche a 37 ºC/5 % de CO2. Después de la incubación, las células se tripsinizaron, lavaron e incubaron durante 3-5 minutos a 37 ºC/5% CO2. Las células se retiraron de los matraces y se añadieron a la placa repelente de células de 6 pocillos a una concentración de 1,2 x 106 células/pocillo.
Se colocó una unidad magnética de 6 pocillos encima de la placa de pocillos para levitar las células, donde se agregaron en estructuras 3D e indujeron la formación de ECM durante una incubación de cinco horas a 37 ºC/5 % de CO2. Después de la incubación, las células y la ECM se rompieron, se resuspendieron y se añadieron a pocillos de placas repelentes de células de 384 pocillos a una concentración total de 1,0×105 células/pocillo, en un volumen de 37,5 μL, junto con 12,5 μL de 4x citocalasina D, para una concentración final 1x de 10-0 μM.
Para las pruebas que involucran fibroblastos y queratinocitos cocultivados, se agregaron al pocillo 5,0×104 células de cada tipo de célula para crear el número total de células de 1,0×105. Se colocó un imán de anillo de 384 pocillos debajo de la placa de pocillos y el conjunto se incubó a 37 ºC/5 % de CO2 durante 20 minutos para permitir que las células dentro de cada pocillo se agregaran en forma de anillo magnético. Después de completar el proceso de agregación, la placa se retiró de la unidad de imán de anillo y se colocó en el Cytation 5. Las imágenes de campo claro automatizadas, utilizando un objetivo de 2x, capturaron el cierre del anillo en todos los pocillos cada 30 minutos durante 16 horas. También se realizaron imágenes de fluorescencia automatizadas, utilizando el canal RFP, en pocillos que contenían fibroblastos primarios a medida que expresan constitutivamente RFP.
Resultados y discusión
Monitoreo de cicatrización de heridas en 3D basado en imágenes sin etiquetas
Siguiendo el protocolo de ensayo, se añadieron 100.000 células HT-1080 totales/pocillo a la placa repelente de células de 384 pocillos donde se realizaron imágenes cinéticas de campo claro. Como se ilustra por la falta de cambios en la estructura del anillo con el tiempo (Figuras 2A-B), la citocalasina D inhibe la cicatrización de heridas por HT-1080. Por el contrario, las Figuras 3A-E ilustran que el anillo celular HT-1080 se contrae en un entorno desinhibido, como se ve durante la cicatrización de heridas in vitro, y también demuestra la capacidad de Cytation 5 para rastrear el movimiento del anillo celular sin inhibiciones durante toda la incubación.

Figura 2. Células HT-1080 tratadas con citocalasina D. Imágenes de campo claro 2x capturadas de pocillos individuales de células HT-1080 tratadas e incubadas de la siguiente manera: (A) citocalasina D 10 μM, 0 horas de incubación; (B) citocalasina D 10 μM, 16 horas de incubación.

Figura 3. Células HT-1080 sin tratar (0 μM de citocalasina D). 2x imágenes de campo claro capturadas de pocillos individuales de células HT1080 no tratadas incubadas durante (A) 0 horas; (B) 4 horas; (C) 8 horas; (D) 12 horas; (E) 16 horas.
A continuación, se analizó el grado de cicatrización de heridas utilizando imágenes de campo claro de Cytation 5. Con los parámetros de la Tabla 1, las máscaras de objetos se colocaron automáticamente alrededor de las estructuras celulares 3D (Figura 4) para rastrear parámetros como el tamaño del objeto, el área y la señal total de campo claro durante el tiempo total de incubación. Como se ve en las imágenes de las Figuras 3 y 4, las estructuras de anillo comienzan como objetos grandes y luego se cierran con el tiempo en respuesta a las fuerzas combinadas que tiran de cada celda individual. Para que los algoritmos de análisis celular del software Gen5 identifiquen correctamente cada anillo como un solo objeto, se necesitan ciertos ajustes.
El tamaño de objeto mínimo y máximo se incrementa para abarcar las estructuras de anillo más pequeñas y grandes. “Dividir objetos en contacto” no está marcado y “Incluir objetos de borde” está marcado para mejorar aún más la identificación de objetos. Finalmente, debido al gran tamaño del objeto, el parámetro avanzado “Tamaño de aplanamiento de fondo” también se incrementa drásticamente. Esto garantiza que la información de la imagen permanezca para la identificación adecuada de los anillos que pueden tener un tamaño superior a 2000 µm. Además, debido al uso de imágenes de campo claro y ligeras variaciones en la intensidad a lo largo de la estructura del anillo, la “Fuerza de suavizado de la imagen” se establece en un valor alto.
Esto y la configuración del tamaño de aplanamiento de fondo también ayudan en la identificación precisa de objetos únicos por pocillo. En conjunto, cada parámetro de análisis permite que el valor de umbral de señal identificado coloque máscaras de objetos alrededor del anillo de manera consistente, particularmente cuando solo existen diferencias sutiles entre los niveles de intensidad de fondo y del anillo. Es importante tener en cuenta que los parámetros del análisis celular pueden variar según el tipo de célula. Siempre se debe realizar la optimización de los parámetros cuando se trabaja con modelos de celda no probados. El área del objeto se utilizó para todos los análisis.
| Parámetros de análisis celular primario de Brightfield | |
| Umbral | 16.000 |
| Tamaño mínimo del objeto | 500 µm |
| Tamaño máximo del objeto | 3000 µm |
| Objetos brillantes sobre un fondo oscuro | Sin marcar |
| Dividir tocar objetos | Sin marcar |
| Incluir objetos de borde | Marcado |
| Opciones avanzadas | |
| Evaluar fondo en | 20 % de los píxeles más bajos |
| Fuerza de suavizado de imagen | 10 |
| Tamaño de aplanamiento de fondo | 10000 µm |
Tabla 1. Parámetros de análisis celular de campo claro Gen5. Como los tipos de celdas varían, la optimización de parámetros siempre debe realizarse con modelos de celdas no probados.
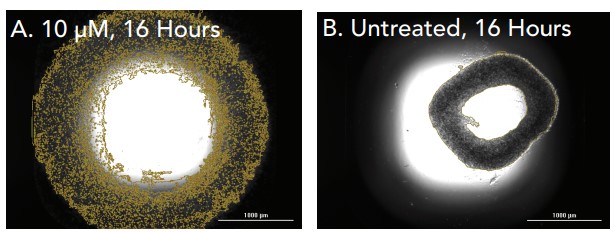
Figura 4. Análisis celular HT-1080 utilizando imágenes de campo claro Cytation 5 2x. Máscaras de objetos mostradas en células tratadas e incubadas como: (A) citocalasina D 10 μM, incubación de 16 horas; (B) citocalasina D 0 μM (sin tratar), incubación de 16 horas.
Finalmente, Cytation 5 calculó el área total de la estructura del anillo celular HT-1080 3D para cada punto de tiempo de 30 minutos, para el análisis de curación de heridas en tiempo real. El porcentaje del área inicial disminuye con el tiempo a medida que se agregan concentraciones más bajas de citocalasina D al pozo. La normalización de datos se llevó a cabo comparando el área total en cada momento con el área inicial (Figura 5). Además, según la Figura 6, se puede usar Cytation 5 para calcular los valores de IC50 de citocalasina D usando datos de un solo punto de tiempo.
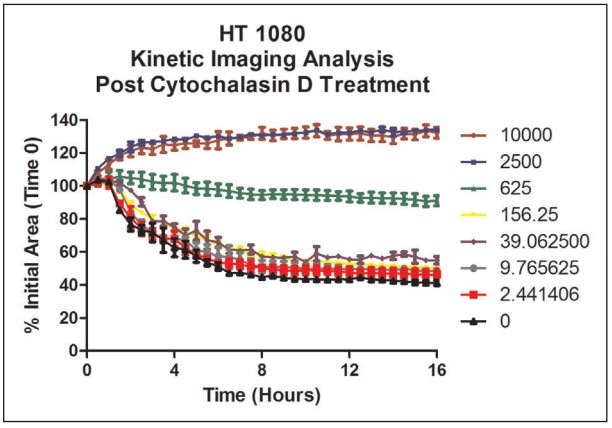
Figura 5. Análisis de cicatrización de heridas HT-1080 utilizando el porcentaje de área inicial dependiente de la dosis. Los valores representan concentraciones nM de citocalasina D analizadas por pocillo.
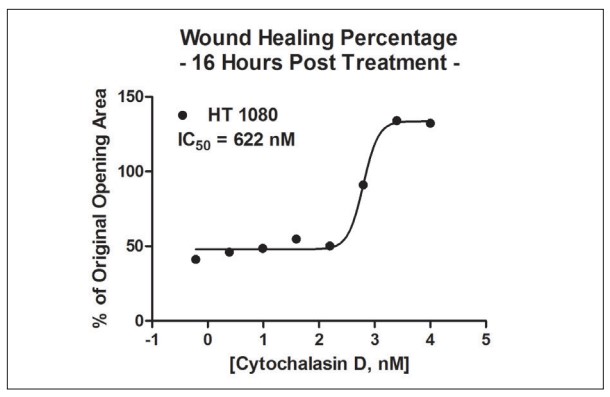
Figura 6. Cálculo de CI50 de cicatrización de heridas posterior a la incubación de HT-1080.
Comparación de fibroblastos primarios
El uso de líneas de células cancerosas inmortalizadas como modelos sustitutos para células primarias ofrece la ventaja de proporcionar una fuente celular continua para fines experimentales. Sin embargo, los cambios internos en la célula cancerosa pueden modificar las características migratorias del modelo celular como lo observaron Varani, et al. al comparar fibroblastos de embrión de ratón normales y células de fibrosarcoma de ratón1. Aquí probamos fibroblastos dérmicos humanos utilizando las condiciones descritas anteriormente para examinar las diferencias potenciales entre las células primarias y la línea celular de fibrosarcoma HT-1080.
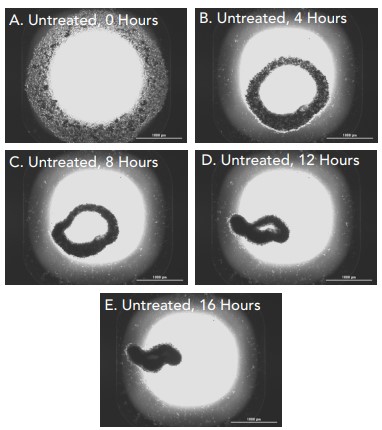 Figura 7. Células de fibroblastos primarios sin tratar (0 μM de citocalasina D). Imágenes de campo claro 2x capturadas de pocillos individuales de células de fibroblastos primarios no tratados incubados durante (A) 0 horas; (B) 4 horas; (C) 8 horas; (D) 12 horas; (E) 16 horas.
Figura 7. Células de fibroblastos primarios sin tratar (0 μM de citocalasina D). Imágenes de campo claro 2x capturadas de pocillos individuales de células de fibroblastos primarios no tratados incubados durante (A) 0 horas; (B) 4 horas; (C) 8 horas; (D) 12 horas; (E) 16 horas.
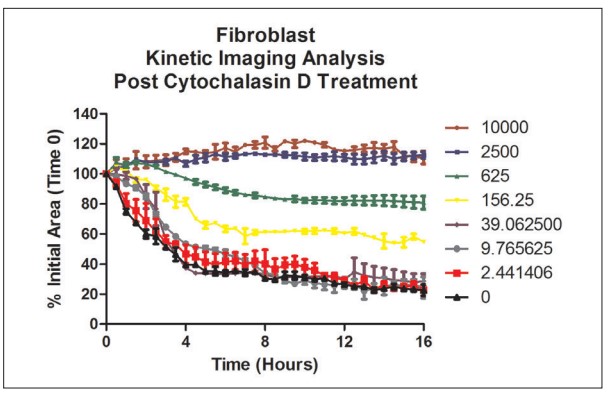 Figura 8. Análisis cinético de cicatrización de heridas con fibroblastos primarios usando un porcentaje del área inicial dependiente de la dosis.
Figura 8. Análisis cinético de cicatrización de heridas con fibroblastos primarios usando un porcentaje del área inicial dependiente de la dosis.
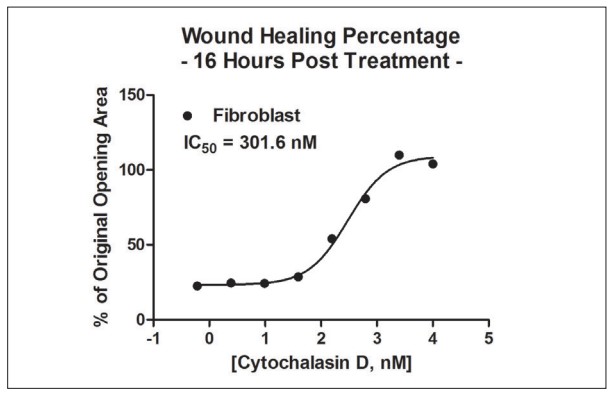 Figura 9. Cálculo de CI50 de curación de heridas con fibroblastos primarios.
Figura 9. Cálculo de CI50 de curación de heridas con fibroblastos primarios.
Cytation 5 se usó nuevamente para calcular el área total del anillo celular en 3D, creado con fibroblastos primarios, para pozos en cada punto de tiempo de 30 minutos. Se observó un mayor porcentaje de cicatrización de heridas utilizando células primarias en comparación con la línea celular cancerosa. Se calcularon los valores de IC50 de citocalasina D utilizando los fibroblastos primarios (Figura 9) y demostraron un desplazamiento a la izquierda en comparación con los valores generados con la línea celular cancerosa.
El análisis de curación de heridas también se puede realizar usando los canales de imágenes fluorescentes de Cytation 5 para células marcadas con una sonda fluorescente o que expresan constitutivamente una proteína fluorescente, como los fibroblastos primarios que expresan RFP que se usan aquí. Se utilizaron máscaras de objetos automatizadas de la Tabla 2 para realizar un seguimiento de los cambios en el área del anillo de celdas 3D (Figura 10). Tenga en cuenta que el contraste mejorado proporcionado por la fluorescencia en relación con la microscopía de campo claro permitió el uso de un umbral más bajo y parámetros de análisis de suavizado y ajuste de fondo menos agresivos. Además, se observaron equivalencias al comparar los patrones cinéticos de cicatrización de heridas (Figura 11) y los valores de IC50 de citocalasina D (Figura 12) de las señales de campo claro y RFP.
| Parámetros de análisis celular primario de Brightfield | |
| Umbral | 5000 RFU |
| Tamaño mínimo del objeto | 500 µm |
| Tamaño máximo del objeto | 3000 µm |
| Objetos brillantes sobre un fondo oscuro | Marcado |
| Dividir tocar objetos | Sin marcar |
| Incluir objetos de borde | Marcado |
| Opciones avanzadas | |
| Evaluar fondo en | 5% de los píxeles más bajos |
| Fuerza de suavizado de imagen | 3 |
| Tamaño de aplanamiento de fondo | Auto |
Tabla 2. Parámetros de análisis celular Gen5 RFP. Como los tipos de celdas varían, la optimización de parámetros siempre debe realizarse con modelos de celdas no probados.
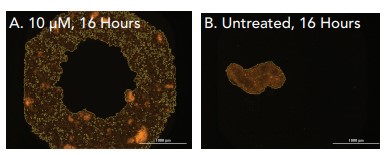 Figura 10. Análisis celular de fibroblastos primarios utilizando imágenes Cytation 5 2x RFP. Máscaras de objetos mostradas en células tratadas e incubadas como: (A) citocalasina 10 μM, incubación de 16 horas; (B) citocalasina 0 μM (sin tratar), incubación de 16 horas.
Figura 10. Análisis celular de fibroblastos primarios utilizando imágenes Cytation 5 2x RFP. Máscaras de objetos mostradas en células tratadas e incubadas como: (A) citocalasina 10 μM, incubación de 16 horas; (B) citocalasina 0 μM (sin tratar), incubación de 16 horas.
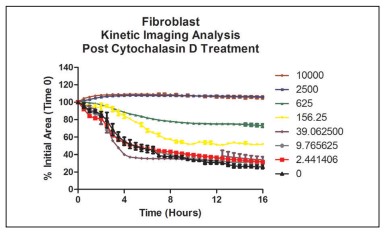 Figura 11. Cicatrización cinética de heridas con fibroblastos primarios usando análisis celular del canal RFP por tratamiento de concentración de citocalasina D.
Figura 11. Cicatrización cinética de heridas con fibroblastos primarios usando análisis celular del canal RFP por tratamiento de concentración de citocalasina D.
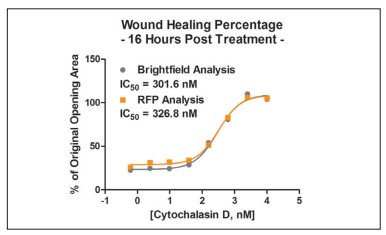 Figura 12. Comparación de los cálculos de campo claro de fibroblastos primarios y RFP IC50.
Figura 12. Comparación de los cálculos de campo claro de fibroblastos primarios y RFP IC50.
Análisis de cultivo conjunto de fibroblastos y queratinocitos
Finalmente, se examinó la curación de heridas en cultivo conjunto. Werner, et al. demostraron que las interacciones entre los queratinocitos y los fibroblastos dominan muchas fases del proceso de cicatrización de heridas2. Por lo tanto, la incorporación de un cultivo conjunto de estos dos tipos de células, como se muestra a continuación, puede proporcionar una representación más precisa de la cicatrización de heridas in vivo.
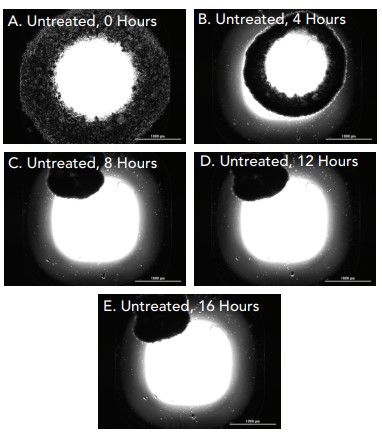 Figura 13. Fibroblastos y queratinocitos primarios no tratados (citocalasina 0 µM). Imágenes de campo claro 2x capturadas de pocillos individuales de cocultivo sin tratar incubados durante (A) 0 horas; (B) 4 horas; (C) 8 horas; (D) 12 horas; (E) 16 horas.
Figura 13. Fibroblastos y queratinocitos primarios no tratados (citocalasina 0 µM). Imágenes de campo claro 2x capturadas de pocillos individuales de cocultivo sin tratar incubados durante (A) 0 horas; (B) 4 horas; (C) 8 horas; (D) 12 horas; (E) 16 horas.
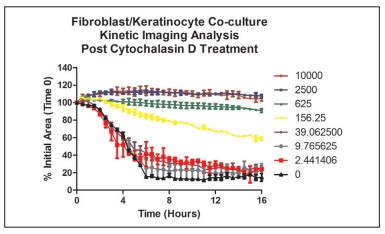 Figura 14. Análisis de cicatrización de heridas de cocultivo cinético utilizando el porcentaje de área inicial dependiente de la dosis de citocalasina D.
Figura 14. Análisis de cicatrización de heridas de cocultivo cinético utilizando el porcentaje de área inicial dependiente de la dosis de citocalasina D.
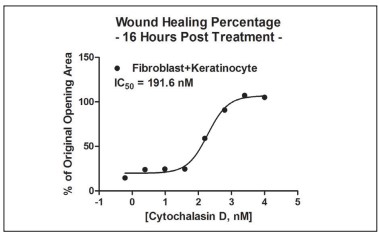 Figura 15. Cálculo de CI50 de cicatrización de heridas posterior a la incubación de cocultivo.
Figura 15. Cálculo de CI50 de cicatrización de heridas posterior a la incubación de cocultivo.
Las Figuras 13 y 16, y el gráfico de la Figura 17 de cicatrización de heridas desinhibida para todos los modelos celulares, demuestran que el cultivo conjunto de fibroblastos/queratinocitos aumentó las tasas de cicatrización de heridas en comparación con los fibroblastos solos o las células cancerosas. El anillo 3D cocultivado se cierra por completo a la séptima hora, en comparación con el cierre moderado con los modelos de células restantes. Además, la curva HT-1080 IC50 fue claramente diferente de los otros modelos celulares, como se ve en la Figura 18. La línea celular cancerosa demuestra una curva extremadamente inhibidora del sueño y una cicatrización de heridas significativamente menor que los otros dos modelos celulares. Estos resultados validan la necesidad para la inclusión de modelos celulares apropiados al realizar análisis de cicatrización de heridas.
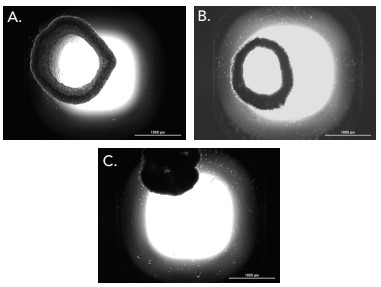 Figura 16. Comparación del modelo celular de cicatrización de heridas. Imágenes 2x capturadas de células HT-1080 no tratadas (A); (B) fibroblastos primarios; (C) fibroblastos y queratinocitos cocultivados; cada uno se incubó durante 7 horas.
Figura 16. Comparación del modelo celular de cicatrización de heridas. Imágenes 2x capturadas de células HT-1080 no tratadas (A); (B) fibroblastos primarios; (C) fibroblastos y queratinocitos cocultivados; cada uno se incubó durante 7 horas.
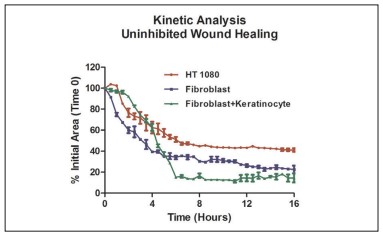 Figura 17. Comparación del modelo celular de tasa de cicatrización de heridas.
Figura 17. Comparación del modelo celular de tasa de cicatrización de heridas.
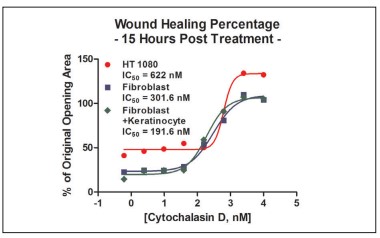 Figura 18. Comparación del modelo de células IC50 de cicatrización de heridas.
Figura 18. Comparación del modelo de células IC50 de cicatrización de heridas.
Conclusiones
El kit de ensayo BiO de 384 pocillos y las partículas NanoShuttle-PL fabricadas por nano3D Biosciences proporcionan un método simple y sólido para llevar a cabo evaluaciones de cicatrización de heridas en 3D, mientras que la incorporación de las microplacas Greiner Bio-One Cell-Repellent Surface de 6 pocillos y de 384 pocillos permite levitación celular eficiente para la creación de ECM y rendimiento de alto rendimiento del ensayo de cicatrización de heridas en 3D. La adición de Cytation™ 5, con imágenes y análisis automatizados en canales de imágenes de campo claro y fluorescencia, simplifica el proceso de ensayo y aumenta la precisión del análisis al eliminar las determinaciones manuales.
Al mismo tiempo, el uso de células primarias puede conducir a una mejor comprensión de la cicatrización de heridas dérmicas in vivo en comparación con las células cancerosas, y el uso de modelos celulares apropiados, incluidas las células primarias y cultivadas conjuntamente, puede afectar la extensión y la velocidad de cicatrización de heridas. , además de la sensibilidad a las moléculas de prueba. La combinación del método de ensayo y la imagen y el análisis automatizados crea un método robusto y fácil de usar para generar resultados precisos y repetibles cuando se utiliza para importantes aplicaciones de cicatrización de heridas dérmicas.
Referencias
- Varani, J.; Orr, W.; Ward, P.A. A comparison of the migration patterns of normal and malignant cells in two assay systems. Am J Pathol. 1978, 90(1), 159-171.
- Werner, S.; Krieg, T.; Smola, H. Keratinocyte-fibroblast interactions in wound healing. J Invest Dermatol. 2007, 127(5), 998-1008.

