Se desarrolló un modelo in vitro para la citotoxicidad mediada por natural killers (NK) utilizando una tecnología de cultivo de células 3D de andamio basado en colágeno. Esta tecnología indujo a las células HCT116 a agregarse en tumoroides con el tiempo, que se convirtió en el objetivo células durante el ensayo de citotoxicidad.
La citotoxicidad se evaluó mediante la exposición a fosfatidilserina (apoptosis) y la ruptura de la membrana plasmática (necrosis) utilizando flujos de trabajo completamente automatizados. La citotoxicidad se cuantificó usando células NK solas y con estimulación con IL-2, donde se evidenció un aumento significativo de la citotoxicidad. La citotoxicidad con este modelo se comparó con las células HCT116 adheridas a microplacas en un formato 2D convencional. El modelo 3D fue muy superior tanto en el mantenimiento de la salud celular a lo largo del tiempo como en la representación precisa de los eventos citotóxicos.
Autores: Brad Larson Agilent Technologies, Inc. Lubna Hussain Lonza Walkersville Inc. Jenny Schroeder Lonza GmbH
Introducción
Las células NK son linfocitos citotóxicos que se encuentran en la sangre periférica y que desempeñan un papel en la defensa del huésped y la regulación inmunitaria. Las células NK son particularmente interesantes en la inmunoterapia debido a su potencial para atacar y destruir células cancerosas específicas, mientras dejan intactas las células sanas que no son el objetivo. Se ha demostrado que la actividad anticancerígena de las células NK está asociada con un mejor pronóstico en varios tipos de cáncer, como el cáncer colorrectal1, el cáncer de pulmón de células no pequeñas2 y el carcinoma de células renales de células claras.3
Para estudiar adecuadamente la interacción entre las células NK y las células tumorales diana, se debe establecer un sistema de modelo in vitro adecuado. Sin embargo, gran parte de los datos publicados hasta la fecha utilizan células cancerosas sembradas como una monocapa bidimensional (2D) en el fondo de los pocillos de las microplacas. Una cantidad creciente de datos ha demostrado que las células cultivadas de esta manera carecen de la comunicación célula:célula y célula:matriz, los gradientes metabólicos y la polaridad demostrados in vivo.4 La capacidad de realizar estudios de infiltración de matriz también se elimina con el uso de células 2D. cultura. Al incorporar células cancerosas en una matriz tridimensional (3D) y permitir la formación de tumoroides, se pueden superar las deficiencias del uso de células cultivadas en 2D. a medida que se restablecen las redes de comunicación y los gradientes celulares observados dentro de los tumores in vivo.
Sin embargo, con la incorporación de células cultivadas en 3D, los métodos tradicionales para monitorear las interacciones de células NK y diana, y la destrucción subsiguiente de células diana pueden volverse problemáticos. Ensayos de lectores de microplacas diseñados para detectar señales de las monocapas celulares carecen de la sensibilidad para cuantificar la señal de los tumoroides rodeados por áreas que no contienen células en el pozo sin generación de señal. Al incorporar la detección basada en microscopía y el análisis celular, se cuantifica la señal que emana únicamente de los tumoroides, lo que proporciona un método muy sólido para detectar la toxicidad inducida dentro de las células cancerosas diana.
Esta nota de aplicación describe una nueva célula NK 3D Ensayo de citotoxicidad mediada (CMC). Uso de la balsa 3D sistema de cultivo celular (Figura 1), las células de cáncer colorrectal HCT116 se incrustaron dentro de un hidrogel de colágeno de concentración y espesor definidos, imitando la matriz extracelular (ECM) in vivo. Después de la propagación celular para crear tumoroides dentro de la matriz, las células NK se marcaron con un tinte de seguimiento celular y se agregaron a los pozos apropiados. También se agregaron sondas fluorescentes de apoptosis y necrosis para rastrear eventos citotóxicos dentro de los tumoroides. Las imágenes celulares y el análisis se realizaron a intervalos regulares utilizando un incubadora durante un período de siete días para monitorear la apoptosis inducida por células NK y la necrosis de las células HCT116 que forman cada tumoroide. Se realizó el efecto de la estimulación de IL-2 en estos eventos citotóxicos, así como una comparación con el mismos experimentos realizados en una monocapa de células HCT116 adheridas.
Materiales y métodos
Materiales
Células: células de carcinoma epitelial colorrectal HCT116
(número de pieza CCL-247) se obtuvieron de ATCC (Manassas, VA). Lonza (Walkersville, MD) donó natural killers (NK) CD56+ CD16+ de sangre periférica seleccionadas negativamente (número de pieza 2W-501).
Ensayo y componentes experimentales: El RAFT Kit pequeño de 96 pocillos, que incluye reactivos y absorbentes, (número de pieza 016-1R17) y LGM-3 (Medio de crecimiento de linfocitos-3) (número de pieza CC-3211) fueron generosamente donado por Lonza. Microplacas tratadas con TC de 96 pocillos (número de pieza 655090) fueron donados por Greiner Bio-One, Inc., (Monroe, Carolina del Norte). Tinte CellTracker Deep Red (número de pieza C34565) se obtuvo de Thermo Fisher Scientific (Waltham, MA). Abcam (Cambridge, MA) donó el kit de apoptosis cinética, que contiene pSIVA-IANBD, una sonda fluorescente verde que detecta la exposición a fosfatidilserina, y yoduro de propidio, una sonda impermeable a la membrana de las células plasmáticas (número de pieza ab129817). IL-2 ES (número de pieza 130-097-744) fue donado por Miltenyi Biotec (San Diego, CA).
Lector multimodo de imágenes de células Agilent BioTek Cytation 5: Cytation 5 es un lector de microplacas multimodo modular combinado con microscopía digital automatizada. La lectura de microplacas basada en filtro y monocromador está disponible, y el módulo de microscopía proporciona una amplia variedad de aumentos en fluorescencia, campo claro, campo claro de color y contraste de fase utilizando objetivos que van desde 1,25x hasta 60x. El instrumento puede realizar imágenes de fluorescencia en hasta cuatro canales en un solo paso. Con especial énfasis en los ensayos de células vivas, Cytation 5 cuenta con control de temperatura a 65 °C, control de gas CO2/O2 e inyectores duales para ensayos cinéticos, y está controlado por el software integrado de lector de microplacas y generador de imágenes Agilent BioTek Gen5. El generador de imágenes y el software se utilizaron para capturar imágenes fluorescentes y de campo claro para ensayos de CMC 2D y 3D y cuantificar el nivel de citotoxicidad inducida por NK.
Incubadora automatizada Agilent BioTek BioSpa 8: La incubadora automatizada BioSpa 8 vincula lectores o reproductores de imágenes Agilent BioTek con lavadoras y dispensadores Agilent BioTek para una automatización completa del flujo de trabajo de hasta 8 microplacas. Los niveles de temperatura, CO2/O2 y humedad se controlan y supervisan a través del software Agilent BioTek BioSpa para mantener un entorno ideal para los cultivos celulares durante todas las etapas experimentales. Las placas de prueba se incubaron en el BioSpa y se transfirieron automáticamente al Cytation 5 en los puntos de tiempo designados, como se indicó en una nota de aplicación anterior, para monitorear la citotoxicidad en células cultivadas en 2D y 3D.
Métodos
Preparación de células diana 2D y 3D y efectoras NK: Activado
El día 0, las células diana HCT116 se mezclaron con la suspensión RAFT Collagen I preparada y se distribuyeron en microplacas tratadas con TC de 96 pocillos en un volumen de 240 μL para producir 1200 células/pocillo. La placa de células se incubó a 37 °C/5 % de CO2 durante 15 minutos, seguido de la adición de absorbentes en la placa RAFT y una segunda incubación de 15 minutos a durante el cual el proceso RAFT concentró la densidad del colágeno a una fuerza fisiológicamente relevante. A continuación, se retiraron los absorbentes y se añadieron 100 μl de medio nuevo al hidrogel concentrado de células/colágeno. (Figura 1). Las células se propagaron a 37 °C/5 % de CO2 en las placas durante siete días para permitir la creación de tumoroides a través de duplicación celular, con intercambio de medios cada dos días. En Día 6, un total de 3000 células/pocillo de células HCT116 previstas para el cultivo 2D se agregaron a una microplaca separada tratada con TC de 96 pocillos y se permitió que se adhirieran durante la noche.
El día 7, se prepararon células NK CD56+ CD16+ de sangre periférica seleccionadas negativamente. Las células NK crioconservadas se descongelaron y diluyeron en LGM-3 (Lymphocyte Growth Medium-3) según el protocolo del fabricante, luego se tiñeron con el tinte fluorescente CellTracker Deep Red. Las células NK se diluyeron a una concentración que equivalía a una proporción de 20:1 o 10:1 de poblaciones finales de HCT116 por pocillo en medios que contenían el kit de apoptosis cinética pSIVA-IANBD de abcam y reactivos de yoduro de propidio y 500 U/ml de IL-2 IS humana o reactivos del kit de apoptosis solos , y agregado a los tumoroides 3D y las células cultivadas en 2D.
Proceso de citotoxicidad mediado por células automatizado
Después de que las mezclas de células NK diluidas se agregaron a los 96 pocillos 3D y placas de prueba 2D, las placas se colocaron en el BioSpa 8 en 37 °C/5% CO2 durante un período de incubación de 120 horas. El método BioSpa se programó de manera que las placas se trasladaran automáticamente al Cytation 5 cada dos horas, donde se realizaron imágenes fluorescentes para monitorear la citotoxicidad inducida por las células efectoras NK (Figura 2). La cámara de imágenes de Cytation también se mantuvo a 37 °C/5 % de CO2 para garantizar condiciones ambientales constantes de la celda. Los canales de imagen incluidos en el procedimiento experimental fueron los siguientes:
- GFP: sonda fluorescente pSIVA-IANBD que se une a fosfatidilserina (PS) expuesta externamente en células apoptóticas
- Yoduro de propidio (PI): tinte intercalante de PI unido al ADN de la célula necrótica
- CY5: Células NK teñidas con CellTracker Deep Red.
Las imágenes 3D CMC se capturaron con un objetivo 4x y una pila z de 11 cortes con pasos de 10 μm, mientras que las imágenes 2D CMC se capturaron con un objetivo 10x y un montaje de imagen 2 × 2.
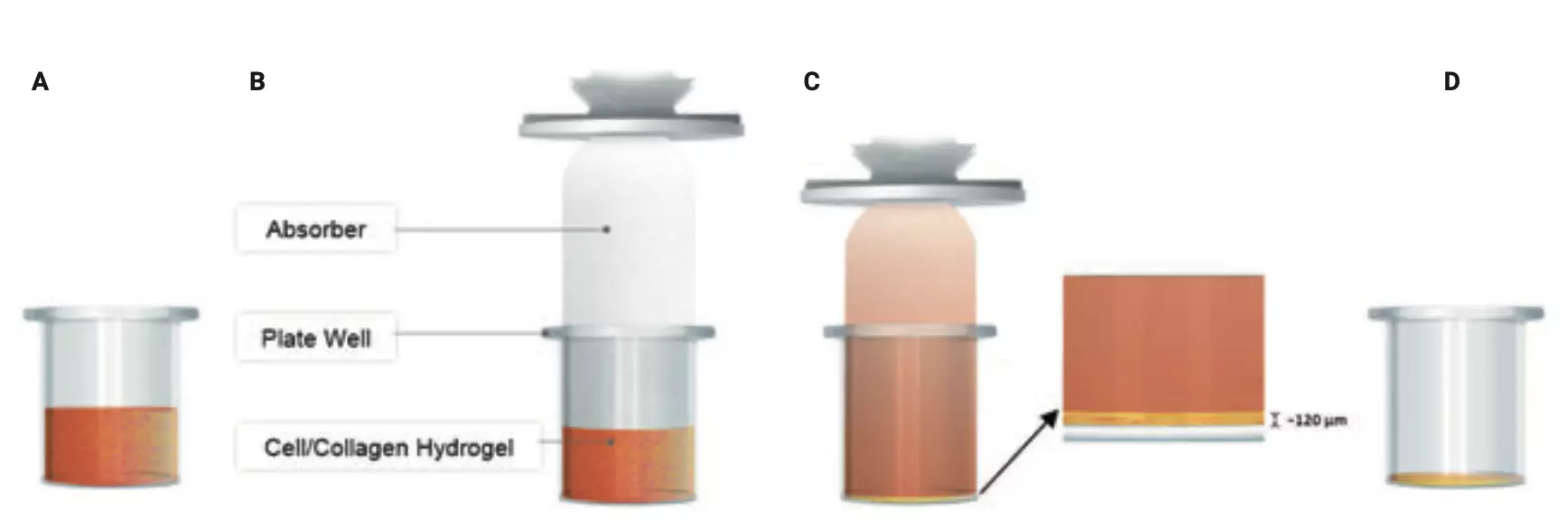 Figura 1. Creación de hidrogel de colágeno/células 3D utilizando el sistema RAFT. (A) Mezcla de células/colágeno dispensada en pocillos de placa tratada con cultivo de tejidos (TC). (B) Inserción del absorbente en el pozo de la placa. (C) Absorción de medio, concentración de colágeno y células a fuerza in vivo, creando un hidrogel de ~ 120 μm de espesor. (D) Eliminación del absorbedor antes de dispensar medio celular nuevo.
Figura 1. Creación de hidrogel de colágeno/células 3D utilizando el sistema RAFT. (A) Mezcla de células/colágeno dispensada en pocillos de placa tratada con cultivo de tejidos (TC). (B) Inserción del absorbente en el pozo de la placa. (C) Absorción de medio, concentración de colágeno y células a fuerza in vivo, creando un hidrogel de ~ 120 μm de espesor. (D) Eliminación del absorbedor antes de dispensar medio celular nuevo.
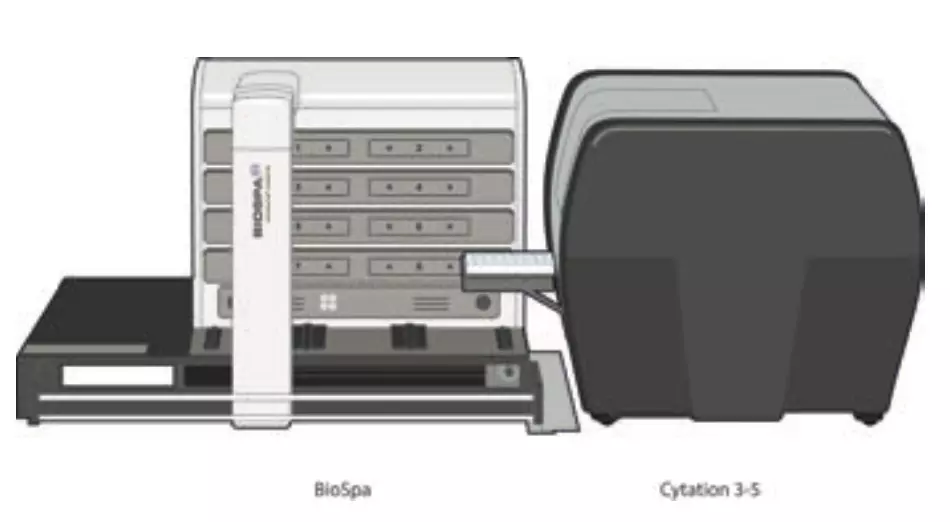 Figura 2. Sistema de análisis de células vivas Agilent BioTek BioSpa compuesto por Agilent Incubadora automática BioTek BioSpa 8 (izquierda) y Agilent BioTek Cytation 5 Lector multimodo de imágenes celulares (derecha) utilizado para automatizar los ensayos de citotoxicidad B mediada por células..
Figura 2. Sistema de análisis de células vivas Agilent BioTek BioSpa compuesto por Agilent Incubadora automática BioTek BioSpa 8 (izquierda) y Agilent BioTek Cytation 5 Lector multimodo de imágenes celulares (derecha) utilizado para automatizar los ensayos de citotoxicidad B mediada por células..
Resultados y Discusión
Formación de imágenes conformacionales de tumoroides
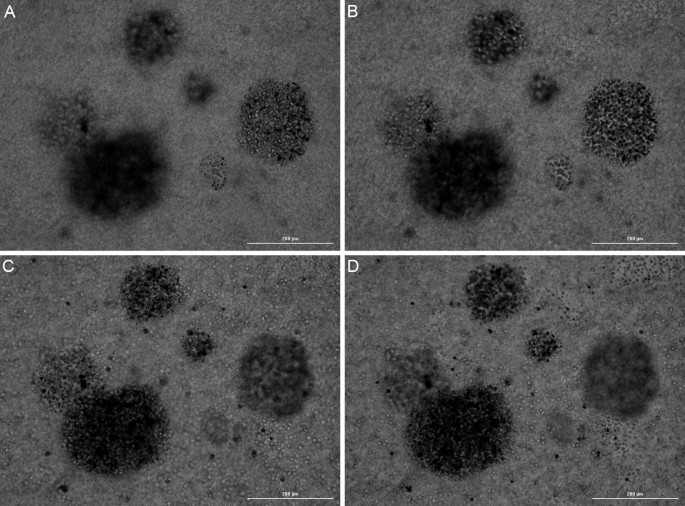
Se realizaron imágenes de campo claro para confirmar que los tumoroides 3D se formaron durante el período de incubación de 7 días a través de la propagación HCT116. Como se muestra en la Figura 3, las células HCT116 inicialmente suspendidas en la matriz de hidrogel RAFT se dividieron continuamente durante el período de incubación de 7 días para crear estructuras multicelulares. El crecimiento 3D y el ensamblaje tumoroide también se confirmaron mediante imágenes capturadas en alturas z separadas en las Figuras 3A a 3C. Aquí, se vio que las células dentro de los diferentes tumoroides capturados en la imagen estaban enfocadas en diferentes planos z, lo que confirma que los tumoroides formados existían en una configuración 3D y no en una capa 2D de células dentro del hidrogel. Luego, se pudo crear una imagen final enfocada utilizando las capacidades de proyección z en el software Agilent BioTek Gen5 para mejorar el análisis celular posterior (Figura 3D).
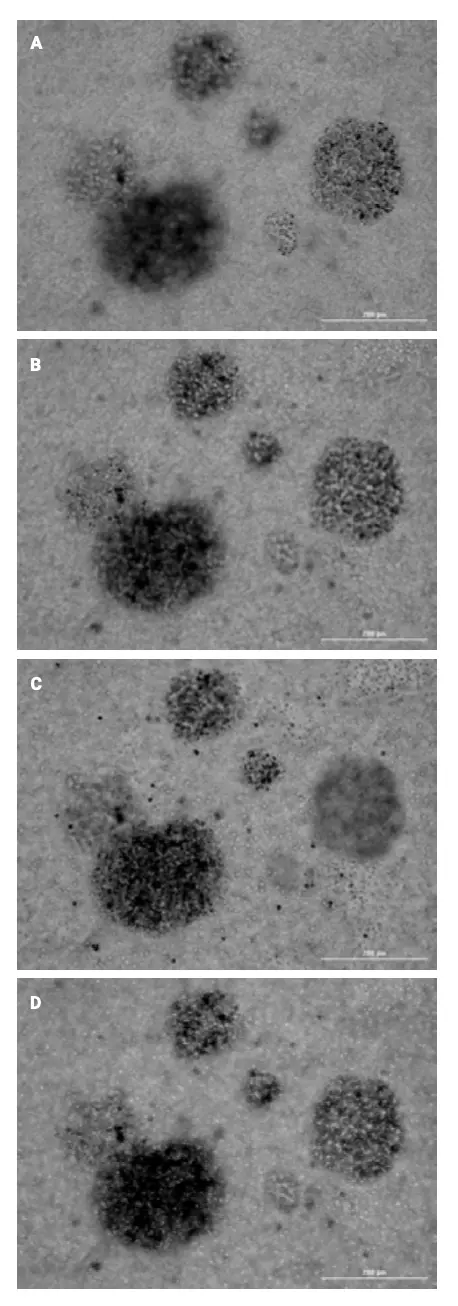 Figura 3. Imágenes conformacionales de formación de tumoroides en 3D. (A,B,C) Imagen de campo claro capturada después de una incubación de 7 días en pocillos de placa utilizando un objetivo 10x en tres alturas z separadas dentro del hidrogel RAFT. (D) Imagen final proyectada en z de tumoroides.
Figura 3. Imágenes conformacionales de formación de tumoroides en 3D. (A,B,C) Imagen de campo claro capturada después de una incubación de 7 días en pocillos de placa utilizando un objetivo 10x en tres alturas z separadas dentro del hidrogel RAFT. (D) Imagen final proyectada en z de tumoroides.
Imágenes de citotoxicidad mediada por células NK en 3D
Después de la adición de células NK a las placas 3D, se capturaron automáticamente imágenes apiladas en z de tumoroides HCT116 cada2 horas durante todo el período de incubación de 120 horas desde pocillos de control positivo tratados con NK 20:1 y 10:1, así como pocillos de control negativo que no contienen células NK (Figura 4). Mediante el uso de proyecciones finales superpuestas de las imágenes apiladas en z, las interacciones de las células NK con los tumoroides HCT116, además de la inducción de células apoptóticas y necróticas, se rastrearon de manera cinética para cada condición de prueba.
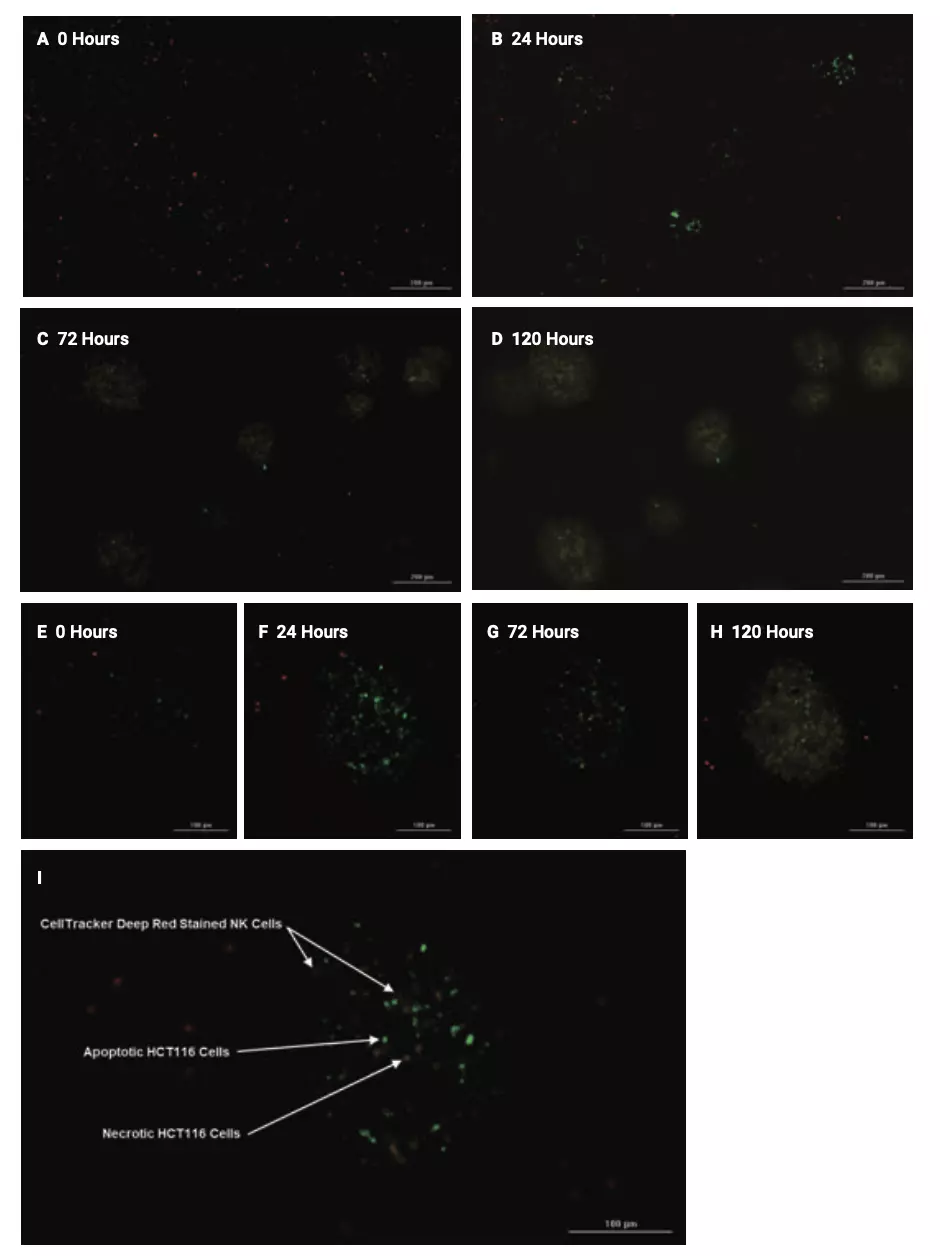 Figura 4. Imágenes de apoptosis y necrosis inducidas por células NK dentro de tumoroides HCT116. (A a D) Imágenes de tumoroides múltiples proyectadas finales superpuestas fluorescentes capturadas con un objetivo de 4x, y (E a H) imágenes de tumoroides individuales ampliadas después del tratamiento con una proporción de 20:1 de células NK estimuladas con IL-2 y 0, 24, 72, o incubaciones de 120 horas, respectivamente. (I) Imagen ampliada y proyectada que muestra células apoptóticas teñidas con pSIVA-IANDB verde, células necróticas teñidas con yoduro de propidio amarillo y células NK marcadas con CellTracker Deep Red rojo.
Figura 4. Imágenes de apoptosis y necrosis inducidas por células NK dentro de tumoroides HCT116. (A a D) Imágenes de tumoroides múltiples proyectadas finales superpuestas fluorescentes capturadas con un objetivo de 4x, y (E a H) imágenes de tumoroides individuales ampliadas después del tratamiento con una proporción de 20:1 de células NK estimuladas con IL-2 y 0, 24, 72, o incubaciones de 120 horas, respectivamente. (I) Imagen ampliada y proyectada que muestra células apoptóticas teñidas con pSIVA-IANDB verde, células necróticas teñidas con yoduro de propidio amarillo y células NK marcadas con CellTracker Deep Red rojo.
Análisis de inducción de necrosis y apoptosis de células NK en 3D
Usando las imágenes apiladas en z, el software Gen5 preprocesó automáticamente las muestras para eliminar el exceso de señal de fondo y preparar la imagen para el análisis cuantitativo. Se realizaron dos pasos de análisis celular separados para colocar máscaras de objetos alrededor de áreas dentro de la imagen que cumplen los criterios de análisis primarios en el canal de imágenes GFP o PI. Los tamaños de objeto mínimos y máximos y los valores de umbral de fluorescencia se establecieron de tal manera que solo apoptóticos o se identificaron áreas necróticas dentro de los tumoroides diana (Figuras 5A y 5B).
Los gráficos de las Figuras 5C y 5D demuestran cómo el área celular dentro de los tumoroides tratados con células NK, identificadas con la sonda fluorescente verde pSIVA-IANBD, aumenta rápidamente durante las primeras 24 horas de exposición y luego vuelve a disminuir hasta los niveles basales. Como exposición externa a fosfatidilserina (PS) es un sello distintivo de la actividad apoptótica temprana, y el reactivo se une al PS expuesto externamente, el fenómeno observado es consistente con los resultados esperados ya que la apoptosis se induce inicialmente dentro de las células tumorales tratadas. A medida que las células NK continúan interactuando con los tumoroides, las células se vuelven cada vez más necróticas y PS una vez más se internaliza dentro de la bicapa lipídica. Esto se confirma por el aumento de la señal de la sonda PI impermeable a las células fluorescentes (Figuras 5E y 5F). La necrosis celular conduce a la pérdida de la integridad de la membrana, lo que permite que el PI se una al núcleo.
Estas cifras también demuestran que los tumoroides HCT116 no tratados mantienen una alta viabilidad celular y aumentos apoptóticos y necróticos observables insignificantes con el tiempo, con o sin estimulación con IL-2. Esto valida aún más que la exposición a las células NK provoca la apoptosis celular HCT116 inicial seguida de necrosis secundaria, y también concuerda con los resultados publicados previamente en la literatura.5
A partir de los datos, es evidente que la mayor proporción de células NK no afecta la cinética de inversión de PS ni de ruptura de la membrana plasmática, pero induce un aumento proporcional en ambos fenotipos según la cantidad relativa de células NK. Finalmente, también se demostró que la estimulación por IL-2 aumenta significativamente la citotoxicidad inducida por NK en comparación con las células NK no activadas en ambas proporciones, de nuevo de acuerdo con anteriores hallazgos de la literatura.6
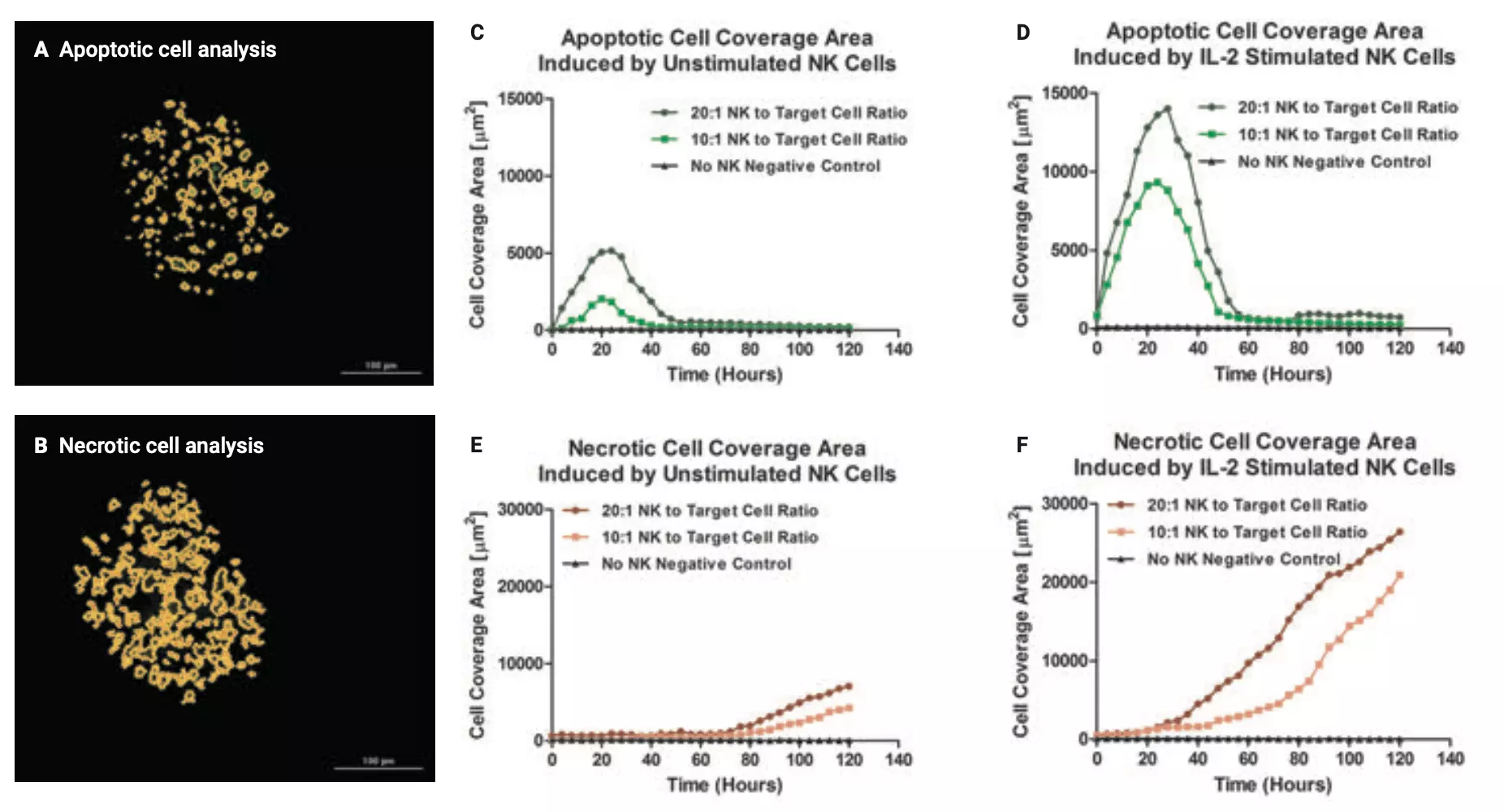 Figura 5. Análisis 3D NK CMC. El software Agilent BioTek Gen5 colocó máscaras de objetos alrededor de (A) células apoptóticas o (B) necróticas durante el análisis individual de imágenes ampliadas de un solo tumoroide. Área de cobertura celular total calculada a partir de máscaras de objetos colocadas alrededor de todas las células apoptóticas dentro de todos los tumoroides en el campo de visión luego de la interacción con (C) células NK no estimuladas o (D) estimuladas con IL-2, y área de cobertura de células necróticas luego de la interacción con (E) células NK no estimuladas o (F) estimuladas con IL-2 en cada punto de tiempo.
Figura 5. Análisis 3D NK CMC. El software Agilent BioTek Gen5 colocó máscaras de objetos alrededor de (A) células apoptóticas o (B) necróticas durante el análisis individual de imágenes ampliadas de un solo tumoroide. Área de cobertura celular total calculada a partir de máscaras de objetos colocadas alrededor de todas las células apoptóticas dentro de todos los tumoroides en el campo de visión luego de la interacción con (C) células NK no estimuladas o (D) estimuladas con IL-2, y área de cobertura de células necróticas luego de la interacción con (E) células NK no estimuladas o (F) estimuladas con IL-2 en cada punto de tiempo.
Imágenes de citotoxicidad mediada por células NK 2D
Se capturaron imágenes de montaje cinético de placas de prueba que contenían células HCT116 y NK cultivadas en 2D o células HCT116 solas mediante el procedimiento de control automatizado mencionado anteriormente (Figura 6). Después del preprocesamiento y unión de imágenes, se llevaron a cabo nuevamente análisis primarios individuales usando el canal GFP o PI en las imágenes completas finales. Gen5 colocó máscaras de objetos alrededor de células apoptóticas o necróticas individuales por imagen (Figuras 7A y 7B).
Es evidente en la Figura 7 que el pico de máxima exposición a PS se retrasa en el formato 2D a aproximadamente 40 horas, que es aproximadamente 2 veces más en relación con 3D. Sin embargo, el inicio de la ruptura de la membrana plasmática ocurre mucho más rápidamente en 2D en relación con 3D, y en el momento del pico Exposición a PS ya hay una ruptura significativa de la membrana plasmática. Por el contrario, las células HCT116 en los tumoroides parecen someterse primero a la exposición a PS y luego a la ruptura de la membrana plasmática en consonancia con la progresión de la apoptosis programada. muerte celular inducida por la actividad de las células NK. Además, después 60 horas, comienza el número de células apoptóticas y necróticas aumentar en el control negativo de células NK. A las 120 horas, hay aproximadamente el mismo número de células apoptóticas en todas las condiciones. Al mismo tiempo, hay niveles significativos de células necróticas en el control negativo: aproximadamente el 50 % del número demostrado en la proporción 10:1; y aproximadamente el 25% de la relación 20:1.
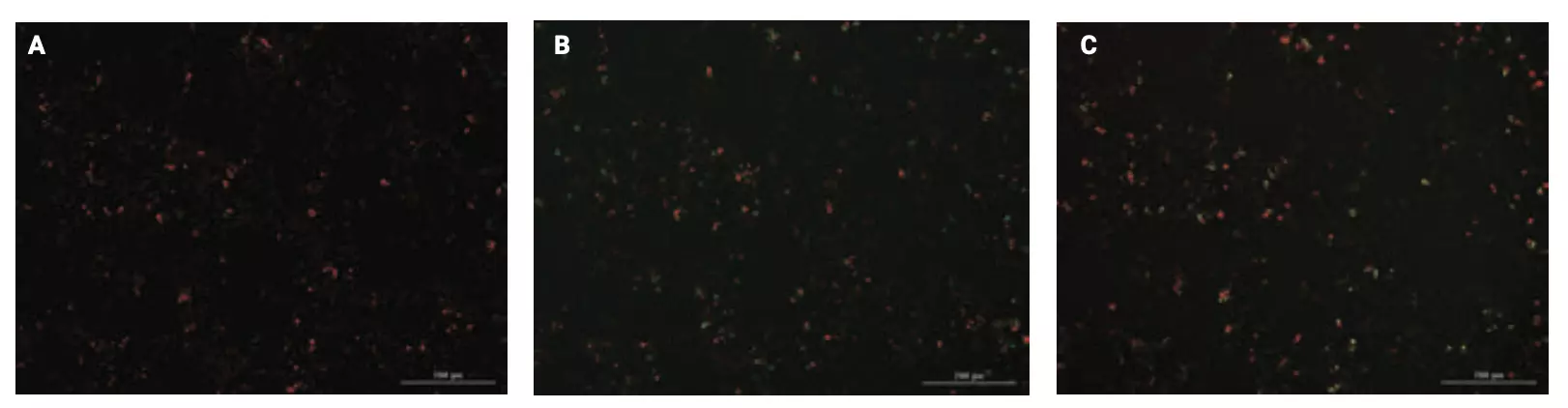 Figura 6. Apoptosis y necrosis inducidas por células NK dentro de células 2D HCT116. Imágenes finales unidas después del tratamiento con una proporción de 20:1 de células NK estimuladas con IL-2 a células HCT116 cultivadas en 2D después de (A) 0, (B) 24 o (C) incubaciones de 120 horas. Verde: células apoptóticas teñidas con pSIVA-IANBD; amarillo: células necróticas teñidas con yoduro de propidio; rojo: Células NK marcadas con CellTracker Deep Red.
Figura 6. Apoptosis y necrosis inducidas por células NK dentro de células 2D HCT116. Imágenes finales unidas después del tratamiento con una proporción de 20:1 de células NK estimuladas con IL-2 a células HCT116 cultivadas en 2D después de (A) 0, (B) 24 o (C) incubaciones de 120 horas. Verde: células apoptóticas teñidas con pSIVA-IANBD; amarillo: células necróticas teñidas con yoduro de propidio; rojo: Células NK marcadas con CellTracker Deep Red.
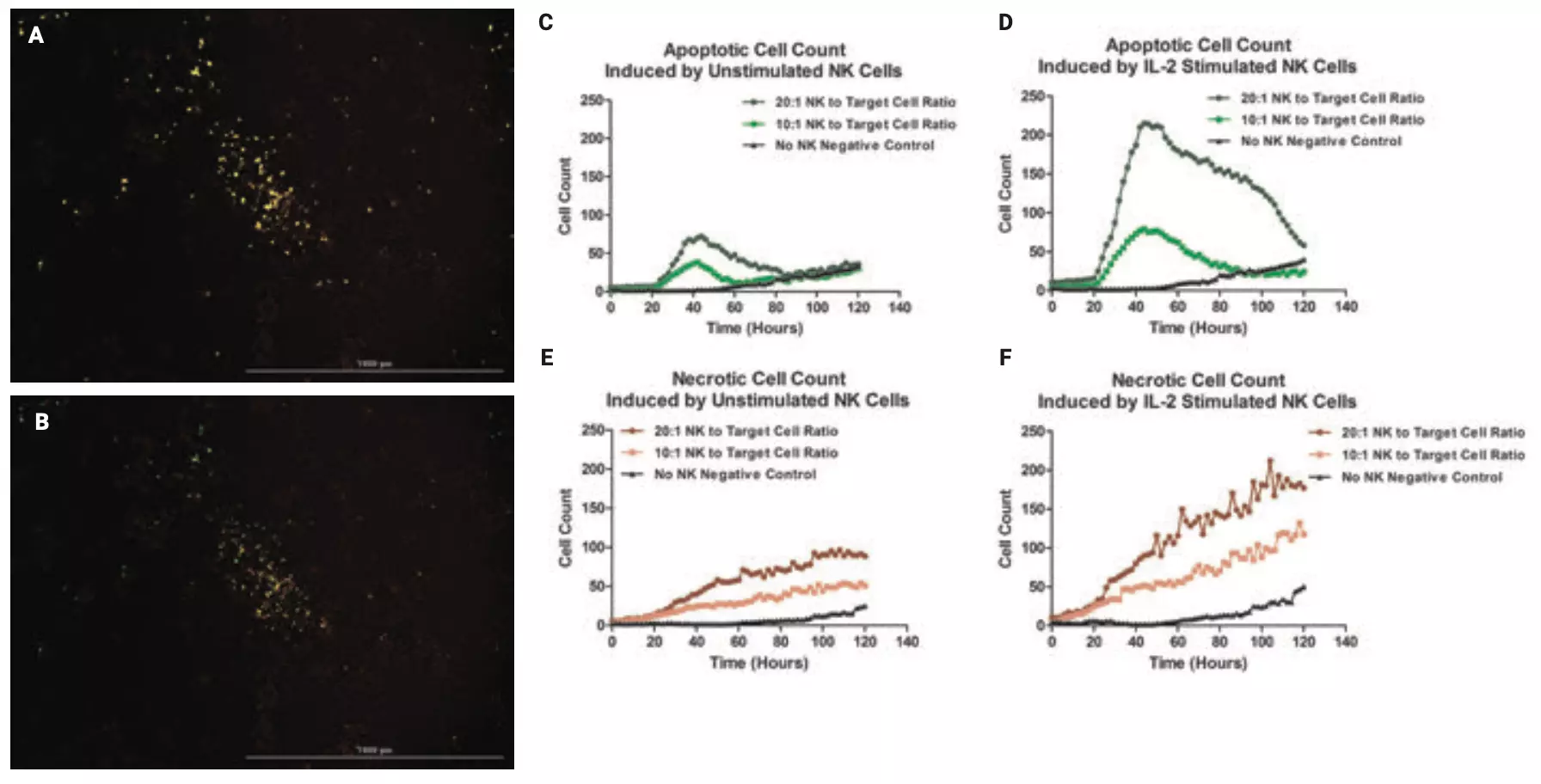 Figura 7. Análisis 2D NK CMC. El software Agilent BioTek Gen5 colocó máscaras de objetos alrededor de (A) células apoptóticas o (B) necróticas durante el análisis individual de imágenes capturadas de placas de prueba 3D. Número total de células calculado a partir de máscaras de objetos colocadas alrededor de todas las células apoptóticas por imagen después de la interacción con (C) células NK no estimuladas o (D) estimuladas con IL-2; y células necróticas después de la interacción con (E) células NK no estimuladas o (F) estimuladas con IL-2 en cada punto de tiempo.
Figura 7. Análisis 2D NK CMC. El software Agilent BioTek Gen5 colocó máscaras de objetos alrededor de (A) células apoptóticas o (B) necróticas durante el análisis individual de imágenes capturadas de placas de prueba 3D. Número total de células calculado a partir de máscaras de objetos colocadas alrededor de todas las células apoptóticas por imagen después de la interacción con (C) células NK no estimuladas o (D) estimuladas con IL-2; y células necróticas después de la interacción con (E) células NK no estimuladas o (F) estimuladas con IL-2 en cada punto de tiempo.
Conclusión
El sistema de cultivo celular RAFT 3D proporciona un modelo útil para ensayos de citotoxicidad mediada por células NK. El flujo de trabajo del ensayo se habilita mediante la automatización utilizando el sistema de análisis de células vivas Agilent BioTek BioSpa que proporciona imágenes cinéticas y cuantificación tanto de la apoptosis (exposición a PS) como de la necrosis (ruptura de la membrana plasmática). Se descubrió que el modelo celular 3D que incorporaba células HCT116 agregadas en tumoroides incrustados en una matriz de colágeno era muy superior a células HCT116 adheridas en monocapa (2D) a microplacas. Las células permanecieron completamente viables durante un período de 120 horas en el control negativo y la citotoxicidad mediada por células NK progresó cinéticamente de manera consistente con la muerte celular programada. Por el contrario, en las células adheridas, se produjo tanto la ruptura de la membrana plasmática como la exposición al PS. en el mismo marco de tiempo y el control negativo contenía grandes proporciones de células citotóxicas durante la última mitad del experimento cinético.
Referencias
- Ohtani, H. Focus on TIL: importancia pronóstica de los linfocitos infiltrantes de tumores en el cáncer colorrectal humano. Inmune al cáncer. 2007, 7(4), 1–9.
- Bruno, A. et al. Un think tank de TINK/TANK: natural killers asociadas a tumor/infiltración tumoral en progresión tumoral y angiogénesis. J. Natl. Instituto de Cáncer 2014, 106(8), 1–13.
- Eckl, J. et al. La firma de la transcripción predice el contenido de células NK tisulares y define los subgrupos de carcinoma de células renales independientemente de la estadificación TNM. J. Mol. Medicina. (Berlín). 2012, 90(1), 55–66.
- Hirschhaeuser, F. et al. Tumoroides tumorales multicelulares: una herramienta subestimada se está poniendo al día nuevamente. J. Biotecnología. 2010, 148(1), 3–15.
- Blom, W. M. et al. Las natural killers activadas con interleucina-2 pueden inducir tanto apoptosis como necrosis en hepatocitos de rata. Hepatología 1999, 29(3), 785–792.
- Lehmann, C. et al. La activación de natural killers con interleucina 2 (IL-2) e IL-12 aumenta la unión de perforina y la subsiguiente lisis de células tumorales. Hermano J. Haematol. 2001, 114(3), 660–665.