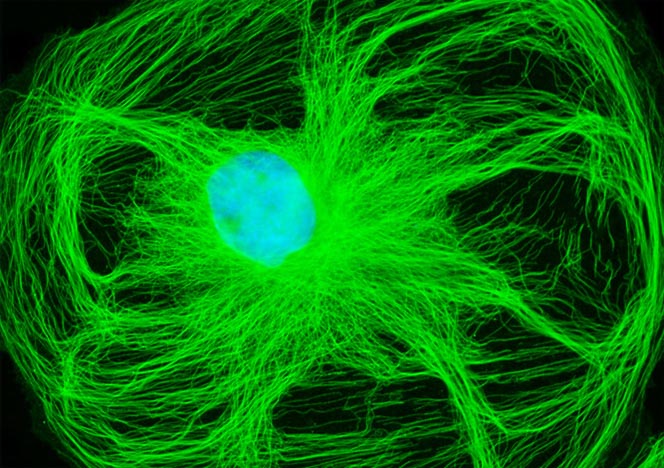
El uso de colorantes fluorescentes en combinación con la fijación celular permite la visualización de procesos celulares que se han conservado en el tiempo. La línea celular PtK2 se usa comúnmente para visualizar las diversas etapas de la mitosis dadas sus características físicas únicas.
Autores: Peter J. Brescia, Jr. and Peter Banks, Applications Department, BioTek Instruments, Inc.,
Winooski, VT
El uso de colorantes fluorescentes en combinación con la fijación celular permite la visualización de procesos celulares que se han conservado en el tiempo. La línea celular PtK2 se usa comúnmente para visualizar las diversas etapas de la mitosis dadas sus características físicas únicas. Ahora hay disponibles microplacas que permiten la microscopía de fluorescencia de alta resolución para visualizar los procesos celulares mitóticos.
Introducción
La mitosis celular, cuando una célula se duplica en dos células hijas idénticas, es un proceso rápido y muy complejo en el ciclo celular de todos los organismos eucariotas multicelulares. Puede ocurrir en varias coyunturas importantes durante la evolución de un organismo, como en la fase de crecimiento y desarrollo o durante el reemplazo celular (células de la piel, glóbulos rojos, etc.), así como la regeneración y la reproducción asexual en algunos organismos. Sigue siendo un área de gran interés dado el papel central que juega en la división celular y la reproducción. Los defectos en la mitosis se han relacionado con la división celular no regulada asociada con muchos tipos de cáncer. Además, se ha demostrado que las células cancerosas que exhiben una división celular no regulada contienen mutaciones en loci genéticos asociados con la regulación de los puntos de control mitóticos1.
La mitosis, junto con la citocinesis, define la fase mitótica o M que representa aproximadamente el 20% del ciclo celular. Si bien el proceso mitótico varía entre los diferentes organismos, en general, los cromosomas en el núcleo celular se separan en dos conjuntos idénticos, cada uno dentro de un núcleo separado. En la mayoría de los casos, la citocinesis sigue inmediatamente a la mitosis, lo que da como resultado una división del citoplasma, los orgánulos y la membrana celular que da como resultado dos células hijas genéticamente idénticas de aproximadamente el mismo tamaño.
El proceso de la mitosis se divide en cinco etapas identificables: profase, prometafase, metafase, anafase y telofase (Figura 1).
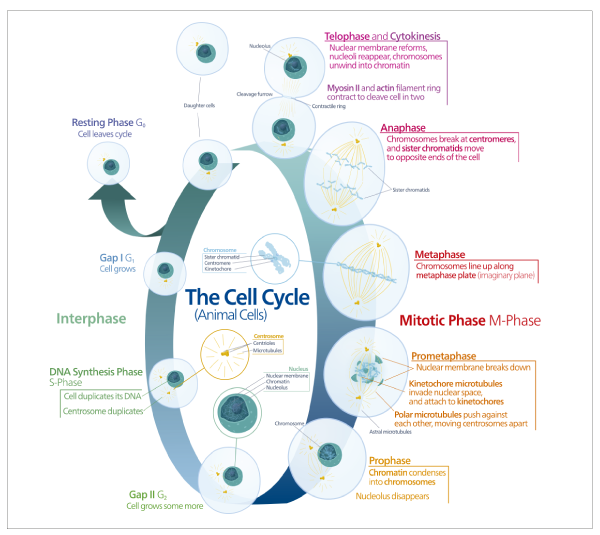 Figura 1. Fase mitótica (fase M). Las etapas de la mitosis incluyen: profase, prometafase, metafase, anafase y telofase y el proceso de citocinesis. Durante el proceso, la cromatina se condensa para formar cromátidas hermanas que se separan y dividen en dos células hijas genéticamente iguales de igual tamaño.
Figura 1. Fase mitótica (fase M). Las etapas de la mitosis incluyen: profase, prometafase, metafase, anafase y telofase y el proceso de citocinesis. Durante el proceso, la cromatina se condensa para formar cromátidas hermanas que se separan y dividen en dos células hijas genéticamente iguales de igual tamaño.
Profase
La membrana nuclear comienza a disolverse y la cromatina comienza a condensarse a partir de pares de cromosomas conectados por un centrómero. Las cromátidas hermanas, resultantes de la duplicación de cada par de cromosomas durante la fase estacionaria o S, se condensan y se adhieren a las fibras de los microtúbulos coordinados por los centrosomas. Cada centrosoma consta de un par de centriolos y actina compuesta de fragmentos de microtúbulos.
Prometafase
Sigue con la desintegración de la membrana nuclear y la invasión de microtúbulos en el espacio nuclear. Al final de la prometafase, los microtúbulos se adhieren a los cinetocoros ubicados en el centro de cada cromátida hermana en el centrómero. Se cree que existen motores moleculares en cada cinetocoro y funcionan en conjunto con la polimerización y despolimerización de los microtúbulos para segregar y luego separar las cromátidas hermanas. Los microtúbulos proporcionan el marco para la formación del huso mitótico que eventualmente separará las cromátidas.
Metafase
Comienza después de la unión de los microtúbulos a los cinetocoros. Los centrosomas comienzan a jalar los cromosomas hacia los polos opuestos de la célula. A medida que comienza este proceso, se ve que los cromosomas se alinean entre los dos centrosomas en la placa metafásica o plano ecuatorial.
Anafase
Comienza con la escisión de las proteínas de unión que unen a las cromátidas hermanas. A medida que las cromátidas viajan a los polos opuestos, adquieren una apariencia clásica en forma de V, ya que son arrastradas por el centrómero con las cromátidas a la zaga. Una vez que los cromosomas han llegado a los extremos opuestos de la célula, el cinetocoro y los microtúbulos asociados se degradan.
Telefase
Es la fase final en la que los microtúbulos polares continúan polimerizándose, forzando la elongación celular. La membrana nuclear comienza a formarse alrededor de cada juego de cromosomas hijos, reaparecen los nucléolos y comienza a ocurrir la descondensación de la cromatina.
Citocinesis
Mientras que la telefase significa el final de la mitosis, la división celular requiere el proceso de citocinesis. En las células animales, se desarrolla un surco de división, formado por un anillo contráctil, en el sitio anterior de la placa metafásica. Finalmente, el anillo se contrae dividiendo la célula y separando los dos núcleos recién formados. Las células vegetales forman una placa celular en el centro de la célula que eventualmente se convertirá en una pared celular, separando nuevamente los dos núcleos.
La célula de la línea de mamíferos PtK2 se derivó de células epiteliales de riñón macho de rata-canguro (Potorous tridactylis) por Wallen y Brown en 1962 para ayudar en el estudio de los cromosomas1. Las células son particularmente buenas para el estudio de la mitosis, ya que solo tienen unos pocos cromosomas grandes adecuados para el análisis microscópico. Además, las células son relativamente grandes y tienden a permanecer planas durante todo el ciclo celular cuando crecen como una monocapa adherente. Las células normalmente experimentan mitosis en promedio cada 2 a 3 horas, lo que permite la posibilidad de capturar células en varias etapas de la mitosis. Actualmente existe un gran repertorio de sondas fluorescentes para ayudar en la visualización de eventos mitóticos en alta resolución. Aquí demostramos la capacidad de capturar imágenes que representan varias etapas del ciclo celular, incluidos los eventos mitóticos, que ocurren en las células PtK2 después de la fijación y tinción celular en microplacas de 96 pocillos.
Materiales y métodos
Materiales
PtK2 (NBL-5), riñón, células Potoroo (Potorous tridactylis) (No. CCL-56 FZ) se adquirieron de ATCC (Manassas, Virginia, EE. UU.). Medios mínimos esenciales (MEM) (No. 10370-021), suero fetal bovino (FBS) (No. 10437-028), enicilina estreptomicina-glutamina, anti-α-tubulina (bovina), IgG1 de ratón, monoclonal (No. A11126), el fragmento Alexa Fluor 488 F9ab)2 de cabra anti-ratón IgG (H+L) (No. A11017) y DAPI (No. D1306) se adquirieron de Life Technologies (Grand Island, NY). Las microplacas Greiner Bio-One SCREENSTAR de 96 pocillos (n.º 6558660) fueron un obsequio de Greiner Bio-One North America, Inc. (Monroe, NC, EE. UU.).
Métodos
Cultivo celular y siembra de microplacas
Los cultivos celulares se mantuvieron a 37 °C, 5 % de CO2 en una incubadora humidificada. Los cultivos se tripsinizaron de forma rutinaria (0,05 % de tripsina-EDTA) al 80 % de confluencia. Para los experimentos, las células se sembraron en placas como una dilución en serie 1:2 de 6 puntos con una densidad celular superior de 10 000 células por pocillo en microplacas SCREENSTAR de 96 pocillos. Las células se incubaron y se dejaron adherir durante la noche antes de la fijación y tinción.
Fijación y tinción
La fijación y tinción celular se realizó como se describió anteriormente con las siguientes modificaciones1. Las células se fijaron lavando una vez con 200 μl de PBS, seguido de la adición de 200 μl de p-formaldehído (PFA) al 4 % e incubación durante 10 minutos a temperatura ambiente (RT). A continuación, las células se lavaron y permeabilizaron lavando 2 x 200 μl de PBS seguido de la adición de 200 μl de PBS suplementado con Triton X-100 al 0,1 % e incubación durante 5 minutos a temperatura ambiente. A continuación, las células se lavaron con 200 μl de PBS + Triton X-100 al 0,1%.
Se añadió anticuerpo primario, 50 μl por pocillo, tubulina anti-alfa de ratón a una dilución de 1:750 en DPBS complementado con 30 mg/ml de BSA y Triton X-100 al 0,1 %, seguido de incubación durante 30 minutos a temperatura ambiente. Las células se lavaron con 200 μl de DPBS, Triton X-100 al 0,1 %. Anticuerpo secundario, 50 μL por pozo, anti-ratón de cabra marcado con Alexa 488 se agregó a una dilución de 1:500 en DPBS suplementado con 30 mg/mL de BSA, 0,1 % de Triton X-100 y se dejó incubar durante 30 minutos a temperatura ambiente. Las células se lavaron 2 x 200 μl con PBS, Triton X-100 al 0,1 %. Se tiñeron simultáneamente con faloidina Texas Red (TR) y DAPI a concentraciones de trabajo de 30 nM y 30 μM, respectivamente, en DPBS, Triton-X 100 al 0,1 % durante 10 minutos a temperatura ambiente. Se lavaron con 200 μL de PBS seguido de la adición de 100 μL de PBS y se sellaron con una película adhesiva transparente TopSeal™-A (No. 6050195, Perkin Elmer, Waltham, MA, EE. UU.) antes de la toma de imágenes.
Imágenes
Se tomaron imágenes de las células usando un lector multimodo de imágenes de células Cytation 3 (BioTek Instruments, Inc., Winooski, VT) configurado con cubos de luz DAPI, GFP y Texas Red. El microscopio utiliza una combinación de fuentes de luz LED junto con filtros de paso de banda para proporcionar la longitud de onda de luz adecuada. El cubo de luz DAPI está configurado con un filtro de excitación 357/44 y un filtro de emisión 447/60; el cubo de luz GFP utiliza un filtro de excitación 470/22 y un filtro de emisión 510/42; mientras que el cubo de luz Texas Red utiliza una excitación 585/29 y filtros de emisión 624/40. Los objetivos instalados incluían una combinación de aumentos de 10x, 20x, 40x y 60x.
Las imágenes se capturaron y almacenaron en formato TIF utilizando el software de análisis de datos Cytation 3 y GEN5 (BioTek Instruments, Inc., Winooski, VT).
Resultados
El uso de tintes fluorescentes para la tinción celular ha llevado a avances significativos en el campo de la microscopía en formas que todavía se están realizando. La capacidad de visualizar procesos celulares y cambios morfológicos a nivel estructural ha sido uno de los usos más perspicaces de tales tintes. Es una práctica común arreglar las celdas, esencialmente preservando su estado existente para su análisis en un momento posterior. Un beneficio principal de combinar la fijación de células con la tinción fluorescente es la capacidad de investigar una población de células más grande que la posible con un cultivo dinámico de células vivas dado el proceso de captura de imágenes, que a veces es largo. Las microplacas SCREENSTAR de mayor densidad utilizadas para este estudio se diseñaron específicamente para el cultivo celular y para satisfacer las demandas de la microscopía avanzada en el descubrimiento de fármacos. Se utilizaron y analizaron densidades de placa de 96 y 384 pocillos para identificar células en diversas etapas de crecimiento celular y fases de mitosis.
Como se demuestra en la Figura 2, las células PtK2 pueden fijarse con PFA al 4 % y teñirse mediante el uso de un conjugado de anticuerpo secundario-Alexa 488 contra un anticuerpo monoclonal dirigido a la proteína tubulina del citoesqueleto, la faloidina TR dirigida a los filamentos de actina F y los núcleos dirigidos a DAPI. Una vez fijadas y teñidas, se puede investigar una gran población de células para capturar imágenes representativas de las diversas etapas del ciclo celular. Es importante muestrear una gran población de células dada la rápida naturaleza de la progresión de la mitosis; del orden de 2-3 horas. Se identificaron muchas etapas del ciclo celular, incluidas varias imágenes de alta resolución de las diversas fases de la mitosis (Figura 2).
Claramente identificables en todas las imágenes están las estructuras nucleares, incluidos los núcleos que contienen la cromatina difusa menos densa y/o las estructuras cromosómicas condensadas teñidas con DAPI (azul). Las Figuras 2a y 2c muestran varias células con núcleos grandes y difusos, mientras que la cromatina condensada (azul) y el comienzo de la formación del huso (verde brillante) son claramente visibles en la célula central de la Figura 2b. La figura 2d muestra un ejemplo de resolución más alta de cromosomas después de la condensación durante la profase de la mitosis después de la disolución del nucléolo y las membranas nucleares. Varias imágenes brindan excelentes ejemplos de la formación del huso y el desarrollo de estructuras de microtúbulos que contribuyen a la alineación, separación y distribución de cromátidas hermanas y la migración de cromosomas a lados opuestos de la célula durante la Metafase hasta la Anafase (Figuras 2d-h).
La telofase y la citocinesis son los eventos finales de la división celular que siguen a la separación de los cromosomas y el citoplasma por igual entre las dos células hijas. Se forma un anillo contráctil creando un surco profundo entre las dos nuevas células. La membrana nuclear se reforma y reaparecen los nucléolos. Con el desenrollado de los cromosomas, los núcleos ahora aparecen nuevamente como estructuras teñidas difusamente (Figura 2i). Las células ahora entrarán en interfase, un período de crecimiento, antes de los ciclos de división posteriores. Alternativamente, una célula puede entrar en un período prolongado de crecimiento y mantenimiento y puede o no experimentar división celular en un momento posterior o puede entrar en un estado de senescencia (envejecimiento biológico).
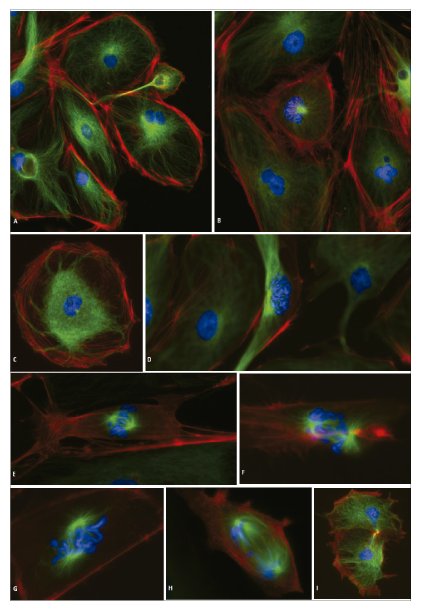 Figura 2. Células PtK2 fijadas y teñidas. Células PtK2 fijadas y teñidas con tintes fluorescentes para tubulina (verde), actina (rojo) y núcleos (azul). Varias etapas de la mitosis se distinguen fácilmente con aumentos que van desde 10x-60x. A) Imagen de células PtK2 con un aumento de 20x, B) una monocapa de células casi confluentes que muestra una célula en la profase tardía de la mitosis, como lo indica la condensación de la cromatina en el centro de la imagen (20x), C) una célula PtK2 individual durante la interfase, una período de crecimiento (20x), D) célula durante la profase tardía resaltando la formación del huso (verde) y la cromatina condensada (azul) en el centro de la imagen (40x) E) célula PtK2 individual durante la metafase con cromosomas alineados en la placa de la metafase (60x), F) visualización de la célula PtK2 durante la Anafase representada por la migración de las cromátidas hermanas a los polos opuestos de la célula (60x) G) Anafase tardía marcada por la migración de los cromosomas hacia las regiones polares de la célula antes de la división celular (60x) H) como células transición entre Anafase y Telofase los cromosomas comienzan a desenrollarse a cromatina y el anillo contráctil comenzará a formarse antes de la citocinesis y I) La citocinesis marca el final de la mitosis marcada por la formación de la membrana nuclear y el nucléolo en cada célula hija (10x).
Figura 2. Células PtK2 fijadas y teñidas. Células PtK2 fijadas y teñidas con tintes fluorescentes para tubulina (verde), actina (rojo) y núcleos (azul). Varias etapas de la mitosis se distinguen fácilmente con aumentos que van desde 10x-60x. A) Imagen de células PtK2 con un aumento de 20x, B) una monocapa de células casi confluentes que muestra una célula en la profase tardía de la mitosis, como lo indica la condensación de la cromatina en el centro de la imagen (20x), C) una célula PtK2 individual durante la interfase, una período de crecimiento (20x), D) célula durante la profase tardía resaltando la formación del huso (verde) y la cromatina condensada (azul) en el centro de la imagen (40x) E) célula PtK2 individual durante la metafase con cromosomas alineados en la placa de la metafase (60x), F) visualización de la célula PtK2 durante la Anafase representada por la migración de las cromátidas hermanas a los polos opuestos de la célula (60x) G) Anafase tardía marcada por la migración de los cromosomas hacia las regiones polares de la célula antes de la división celular (60x) H) como células transición entre Anafase y Telofase los cromosomas comienzan a desenrollarse a cromatina y el anillo contráctil comenzará a formarse antes de la citocinesis y I) La citocinesis marca el final de la mitosis marcada por la formación de la membrana nuclear y el nucléolo en cada célula hija (10x).
Conclusión
La capacidad de visualizar estructuras y procesos celulares con la ayuda de tintes fluorescentes y proteínas ha permitido nuevos conocimientos en diversas áreas de la biología celular. La capacidad de fijar y teñir células utilizando técnicas de inmunotinción dirigidas a distintas estructuras permite investigar una instantánea de eventos biológicamente relevantes en una gran población de células, lo que minimiza el análisis complejo debido a procesos dinámicos. El examen de una población estática de PtK2 permitió visualizar y obtener imágenes de numerosas etapas del ciclo celular y la mitosis utilizando el lector multimodo de imágenes celulares Cytation™ 3.
Referencias
- Kops, G. J. P. L, Weaver, B. A. A., & Cleveland, D. W. (2005) “On the road to cancer: Aneuploidy and the mitotic checkpoint.” Nature Reviews Cancer. 5, 773–785.
- Walen, K.H.; Brown, S.W. (1962). “Chromosomes in a marsupial (Potorous tridactylis) tissue culture.” Nature. 194: 406.
- Held. P. (2005) BioTek Application Note http://www.biotek.com/resources/articles/wash-loosely-adherenttissue.
html