Imágenes de células vivas de apoptosis y necrosis: La muerte celular se produce a lo largo de la vida de un organismo, y esto es fundamental para la plasticidad del desarrollo y la salud del organismo, en parte mediante la eliminación de células innecesarias y no saludables de manera oportuna y eficaz.
Resumen
A lo largo de la vida de un organismo se produce la muerte celular, y esto es fundamental para la plasticidad del desarrollo y la salud del organismo, en parte mediante la eliminación de células innecesarias y no saludables de manera oportuna y eficaz. Sin embargo, la muerte celular disfuncional conduce a enfermedades como el cáncer, la neurodegeneración y el daño isquémico. Esta nota de aplicación investiga la apoptosis y la necrosis en tiempo real durante un período de 48 horas utilizando imágenes de campo claro de alto contraste en combinación con sondas fluorescentes para marcadores de muerte celular apoptótica y necrótica. Este estudio demuestra que la apoptosis y la necrosis se inducen de forma dependiente de la dosis tanto en las células HT-1080 como en las SKOV3.
Introducción
La muerte celular es un componente vital de múltiples procesos biológicos, incluido el recambio celular normal y el desarrollo adecuado. Demuestra un papel complementario pero opuesto a la proliferación en la regulación homeostática de las poblaciones celulares. Muerte de células inapropiada (demasiada o insuficiente) es un factor en muchas enfermedades como el daño isquémico, el cáncer y la neurodegeneración.1 Por lo tanto, la capacidad de modular la vida o muerte de una célula tiene un inmenso potencial terapéutico.
Dos vías clásicas de muerte celular son la apoptosis y la necrosis.
La apoptosis es un proceso activo y programado de muerte celular autónoma que evita provocar una respuesta inmunitaria. Por otro lado, la necrosis es un proceso pasivo descontrolado que resulta en la liberación de contenido citoplasmático inflamatorio en el tejido circundante. Crítico para cada vía única de muerte celular es la forma en que se eliminan los desechos celulares resultantes. Las células apoptóticas muestran una variedad de señales de reconocimiento para los fagocitos que conducen a su conveniente eliminación. La captación de cuerpos apoptóticos suprime la secreción de mediadores inflamatorios de los macrófagos activados. Por el contrario, el contenido celular liberado por las células necróticas incluye moléculas que actúan como señales para promover la respuesta inflamatoria.2
Materiales y métodos
Cultivo de células
Las células HT-1080 se cultivaron en medio Eagle modificado de Dulbecco avanzado (DMEM) (Gibco, Grand Island, NY) con 10 % de FBS (Gibco) y 1x PennStrep-Glutamina (Cellgro, Manassas, VA). Las SKOV3 se cultivaron en medio modificado 5a de McCoy (Gibco) con FBS al 10 % (Gibco) y PennStrep-Glutamina 1x (Cellgro). Se sembraron en microplacas de 96 pocillos de fondo transparente con lados negros (Corning, Corning, NY) a una densidad de 2000 (HT-1080) o 4000 (SKOV3) células por pocillo y se dejaron adherir durante la noche. Las condiciones ambientales, incluida la temperatura (37 °C), el gas (5 % CO2) y la humedad (90 %), se mantuvieron durante la incubación de dos días utilizando una incubadora automática Agilent BioTek Biospa 8.
Inducción de muerte celular y adición de componentes
La muerte celular se indujo tratando las células con diluciones de camptotecina o estaurosporina con concentraciones que oscilan de 10.000 a 2,44 nM y un control sin compuesto. Los medios también contenían reactivos del Kinetic Apoptosis Kit (ab129817), donado por Abcam (Cambridge, MA). La polaridad indicador sensible de viabilidad y apoptosis (pSIVA), un marcador de apoptosis, se añadió al medio a una concentración de 10 µl/ml. El yodo de propidio (PI), un indicador de necrosis, fue añadido al medio a una concentración de 5 µL/mL.
Imagen celular
Las placas de cultivo celular fueron transferidas de la Incubadora Agilent Biotek BioSpa 8 al lector multimodo de imágenes celulares Cytation 5 cada dos horas. Las condiciones ambientales se mantuvieron a 37 °C y 5% de CO2 dentro del Cytation 5 a lo largo de los pasos de imagen. Las imágenes fueron capturadas en 4x en los canales PI, GFP y de campo claro. Dos imágenes de alto contraste de campo claro fueron capturadas en cada punto de tiempo, una imagen enfocada utilizada como referencia y una imagen desenfocada para el conteo de células. Brevemente, las células se enfocaron usando el kit de campo claro de alto contraste. Luego se usó la herramienta de perfil de línea de vista para dibujar una línea que cruzaba las celdas y las secciones de fondo del campo de imágenes. A continuación, se disminuyó la altura focal mientras se observaba el perfil de la línea para determinar la altura focal a la que se lograba el máximo contraste entre el brillo de la celda y el fondo. Luego, este valor se ingresó como una compensación de la imagen de campo claro de alto contraste de referencia.3
Análisis de imagen
Se utilizó el preprocesamiento de imágenes para obtener el mejor realce del contraste, reduciendo cada celda a un solo punto brillante. Para lograr esto, la imagen de alto contraste fue procesado con un fondo negro y una bola rodante de 30 µm. Esto resultó en una imagen oscura con puntos brillantes delineando células. Los parámetros de suavizado de fondo automático fueron utilizado para eliminar la fluorescencia de fondo de la GFP y canales PI. (Figuras 1A a 1C). Umbrales de enmascaramiento de objetos luego se configuraron para identificar cada celda para el conteo. Imágenes fueron analizados por enmascaramiento en el campo claro de alto contraste imágenes y la expansión de la máscara de campo claro para capturar la Señal PI y GFP (Figuras 1G a 1I). La integral PI o GFP en la máscara secundaria se calculó para cada celda. Imagen Los ajustes de preprocesamiento y análisis se presentan en detalle en Tabla 1.
Tabla 1.
Ajustes del Software lector de microplacas y reproductor de imágenes Agilent BioTek Gen5. Parámetros de análisis de imagen para generar una máscara celular en el canal de campo claro de alto contraste. Las máscaras primarias se amplían a abarcar la señal PI y GFP para determinar las integrales.
| Preprocesamiento de imágenes | |
| Conjunto de imágenes | Campo brillante [2] |
| Fondo | Negro |
| Diámetro de la barra rodante | 30 |
| Resultados | Prioritarios finos |
| Fuerza de suavizado de imagen | 0 |
| Conjunto de imágenes | Yoduro de propidio |
| Fondo | Negro |
| Diámetro de la barra rodante | Auto |
| Fuerza de suavizado de imagen | 0 |
| Conjunto de imágenes | GFP |
| Fondo | Negro |
| Diámetro de la barra rodante | Auto |
| Fuera de suavizado de imagen | 0 |
| Análisis Celular | |
| Canal de detección: máscara primaria y cuenta | Tsf [campo brillante [2]] |
| Límite | Auto |
| Fondo | Negro |
| Tamaño mínimo de objeto | 10 |
| Tamaño máximo de objeto | 100 |
| Máscara secundaria | Tsf [yoduro de propidio] |
| Medir dentro de una máscara secundaria | Comprobada |
| Expandir máscara principal | 20 μm |
| Máscara secundaria | Tsf[GFP] |
| Medir dentro de una máscara secundaria | Comprobada |
| Expandir máscara principal | 30 μm |
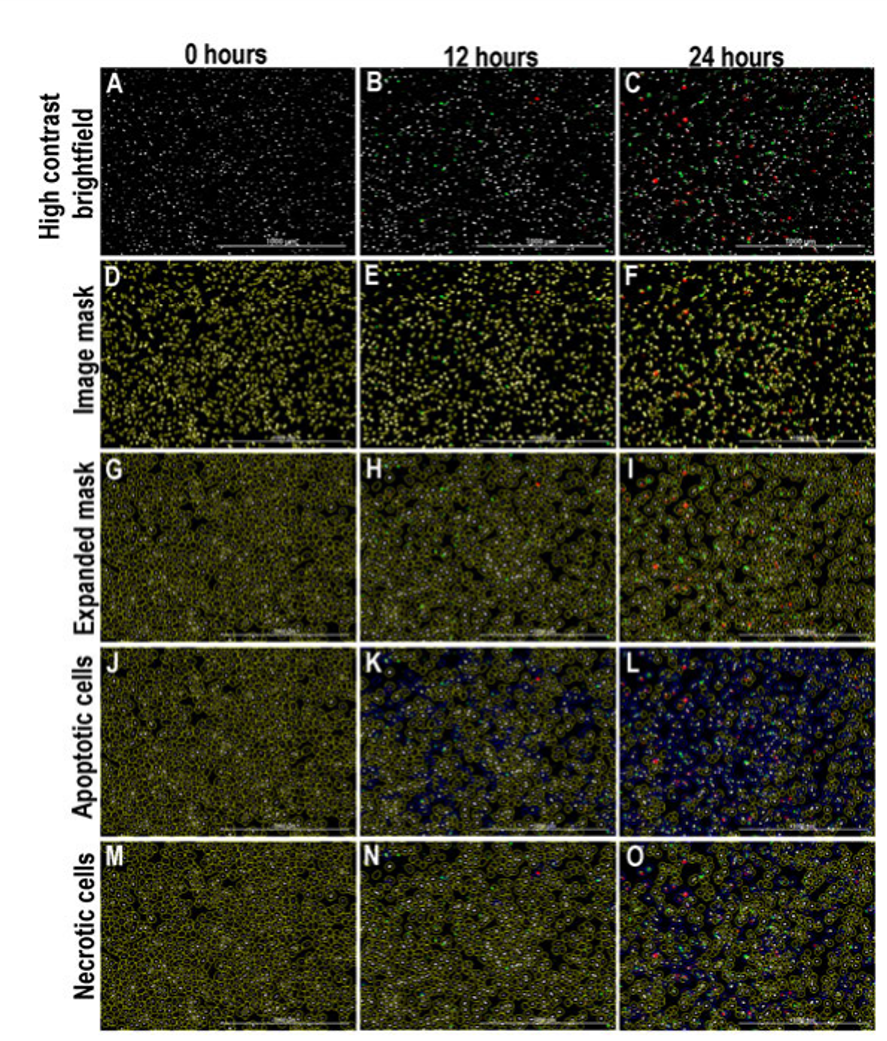 Figura 1. Análisis de imágenes de células apoptóticas y necróticas. Las células HT-1080 se trataron con camptotecina para determinar el efecto del fármaco sobre la respuesta apoptótica y necrótica de las células HT-1080. La primera fila (A-C) muestra preprocesado imágenes de campo claro de alto contraste junto con GFP y PI a las 0 (A), 12 (B) y 24 (C) horas después del tratamiento. La siguiente fila de las imágenes (D-F) muestra la máscara principal que rodea a cada celda individual como se delinea por el preprocesado de alto contraste imagen de campo claro. La fila G-I muestra la máscara expandida que captura más del área de la celda y abarca la GFP y la PI señal. La fila J-L muestra las células apoptóticas resaltadas en azul. La fila M-O indica células necróticas resaltadas en azul.
Figura 1. Análisis de imágenes de células apoptóticas y necróticas. Las células HT-1080 se trataron con camptotecina para determinar el efecto del fármaco sobre la respuesta apoptótica y necrótica de las células HT-1080. La primera fila (A-C) muestra preprocesado imágenes de campo claro de alto contraste junto con GFP y PI a las 0 (A), 12 (B) y 24 (C) horas después del tratamiento. La siguiente fila de las imágenes (D-F) muestra la máscara principal que rodea a cada celda individual como se delinea por el preprocesado de alto contraste imagen de campo claro. La fila G-I muestra la máscara expandida que captura más del área de la celda y abarca la GFP y la PI señal. La fila J-L muestra las células apoptóticas resaltadas en azul. La fila M-O indica células necróticas resaltadas en azul.
Para determinar qué células fueron positivas para la apoptosis o necrosis, se fijó un umbral basado en el pocillo de control negativo (Figura 2). Este umbral se fijó en 2 desviaciones estándar por encima de la media del valor medio del control negativo bien. El porcentaje de células apoptóticas/necróticas totales por punto de tiempo se determinó usando la función de transformación de proporción en la caja de herramientas de reducción de datos.
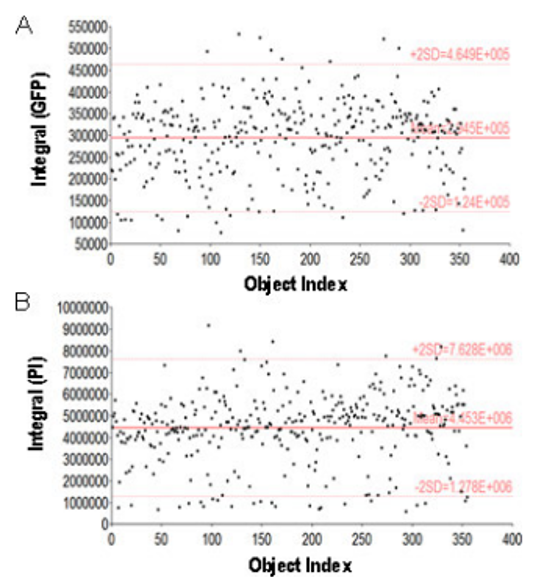
Figura 2. Gráficos de dispersión para los cortes de apoptosis y necrosis. (A) Integral de GFP y (B) se utilizaron integrales de PI de pocillos de control negativo para determinar puntos de corte para células apoptóticas y necróticas con análisis de subpoblaciones. Los se usó el promedio más dos desviaciones estándar como base para determinar células apoptóticas y necróticas positivas.
Resultados y discusión
Una característica de la apoptosis es la expresión de marcadores de superficie celular que dan como resultado el reconocimiento fagocitario temprano de las células apoptóticas, lo que permite la fagocitosis con un compromiso mínimo para el tejido circundante. Esto se logra mediante el movimiento de la fosfatidilserina (PS) normalmente orientada hacia el interior de la bicapa lipídica de la célula hacia la expresión en las capas externas de la membrana plasmática. La externalización de PS es una señal de reconocimiento bien conocida para los fagocitos. Este estudio utilizó una sonda que se une de forma reversible a PS, el indicador de viabilidad y apoptosis sensible a la polaridad (pSIVA). Una característica distintiva de la necrosis es la ruptura de la membrana plasmática, lo que permite la captación de colorantes impermeables a la membrana, como el PI, lo que indica la presencia de células necróticas. El pSIVA y el PI actúan juntos para distinguir entre muerte celular apoptótica y necrótica.
Las células HT-1080
Las células HT-1080 se trataron con camptotecina para determinar el efecto del fármaco sobre la respuesta apoptótica y necrótica de las células HT-1080. La camptotecina es un inhibidor de la topoisomerasa que tiene una alta citotoxicidad en una variedad de líneas celulares. La camptotecina actúa uniéndose al complejo de escisión de la ADN topoisomerasa I, lo que evita la religación de las roturas monocatenarias y provoca la apoptosis.4 Se encontró un aumento de células apoptóticas y necróticas tanto con el tiempo como con la dosis (Figuras 3 y 4).
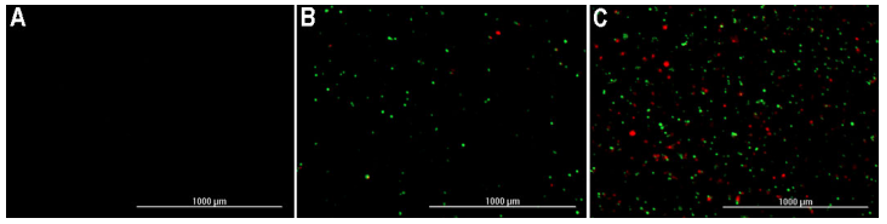 Figura 3. Imágenes de células HT-1080 tratadas con camptotecina. Se muestran imágenes 4x en el tiempo 0 (A), 12 horas (B) y 24 horas (C) de células HT-1080 tratadas con camptotecina 2500 nM y teñidas con PI (rojo, necrosis) y pSIVA (verde, apoptosis). Tanto la apoptosis como la necrosis aumentan con el tiempo y estos resultados demuestran un aumento con el tiempo en el porcentaje de células apoptóticas positivas para GFP y células necróticas positivas para PI.
Figura 3. Imágenes de células HT-1080 tratadas con camptotecina. Se muestran imágenes 4x en el tiempo 0 (A), 12 horas (B) y 24 horas (C) de células HT-1080 tratadas con camptotecina 2500 nM y teñidas con PI (rojo, necrosis) y pSIVA (verde, apoptosis). Tanto la apoptosis como la necrosis aumentan con el tiempo y estos resultados demuestran un aumento con el tiempo en el porcentaje de células apoptóticas positivas para GFP y células necróticas positivas para PI.
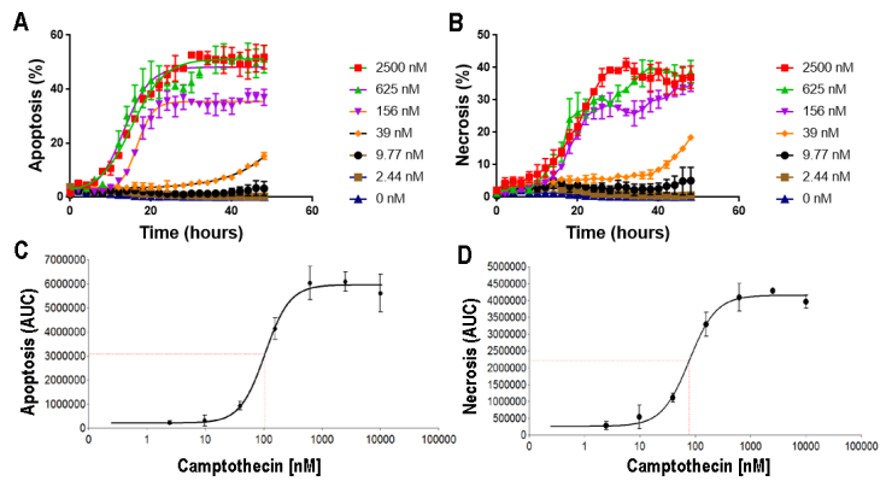 Figura 4. Células HT-1080 tratadas con camptotecina. La apoptosis y la necrosis aumentan de manera dependiente de la dosis, como lo demuestra el curso temporal (A,B) y la dosis respuesta a las 48 horas (C,D).
Figura 4. Células HT-1080 tratadas con camptotecina. La apoptosis y la necrosis aumentan de manera dependiente de la dosis, como lo demuestra el curso temporal (A,B) y la dosis respuesta a las 48 horas (C,D).
A continuación, las células SKOV3 se trataron con camptotecina para determinar el efecto del fármaco sobre la apoptosis y la necrosis respuesta de las células SKOV3. Similar a los resultados con HT-1080 células, se encontró un aumento en las células apoptóticas y necróticas tanto a lo largo del tiempo como según la dosis (Figura 5). Sin embargo, mirar de cerca los dos conjuntos de gráficos revela que, aunque ambas células respondieron de forma dependiente del tiempo y de la dosis manera, hay diferencias inherentes a las respuestas.
Resultados
En las células HT-1080, tanto la apoptosis como la necrosis alcanzaron su punto máximo poco después de 24 horas, donde en las células SKOV3, la apoptosis y la necrosis aumentaron más o menos constantemente después de 20 horas, pero hasta entonces había poca muerte celular. Esto probablemente se deba al hecho de que se sabe que las células SKOV3 son resistentes a los tumores factor de necrosis y varios fármacos citotóxicos. 5 Esto es un buen ejemplo del hecho de que diversos estímulos van a afectar diferentes tipos de células de diferentes maneras.
Las células HT-1080 se trataron con estaurosporina para determinar el efecto de la droga en la respuesta apoptótica y necrótica de células HT-1080. La estaurosporina es una potente proteína quinasa inhibidor que induce la apoptosis en muchos tipos de células. 6 En general, se encontró un aumento en las células apoptóticas y necróticas. En general, se encontró un aumento de células apoptóticas y necróticas tanto a lo largo del tiempo como según la dosis (Figura 6). Sin embargo, en el caso de la inducción de necrosis a las dosis más altas, hay un pico agudo a las 12 horas que luego cae a medida que el ADN nuclear unido al PI se pierde de la célula y se difunde fuera del plano de la imagen.
Finalmente, las células SKOV3 se trataron con estaurosporina para determinar el efecto del fármaco sobre la respuesta apoptótica y necrótica de las células SKOV3. De manera similar a los resultados anteriores, se encontró un aumento en las células apoptóticas y necróticas tanto con el tiempo como con la dosis (Figura 7). Sin embargo, en comparación con la respuesta de las células SKOV3 a la camptotecina, cuando se expusieron a la estaurosporina, hubo una respuesta apoptótica y necrótica general ligeramente mayor, lo que destaca el hecho de que las mismas células responden de manera diferente a diferentes estímulos.
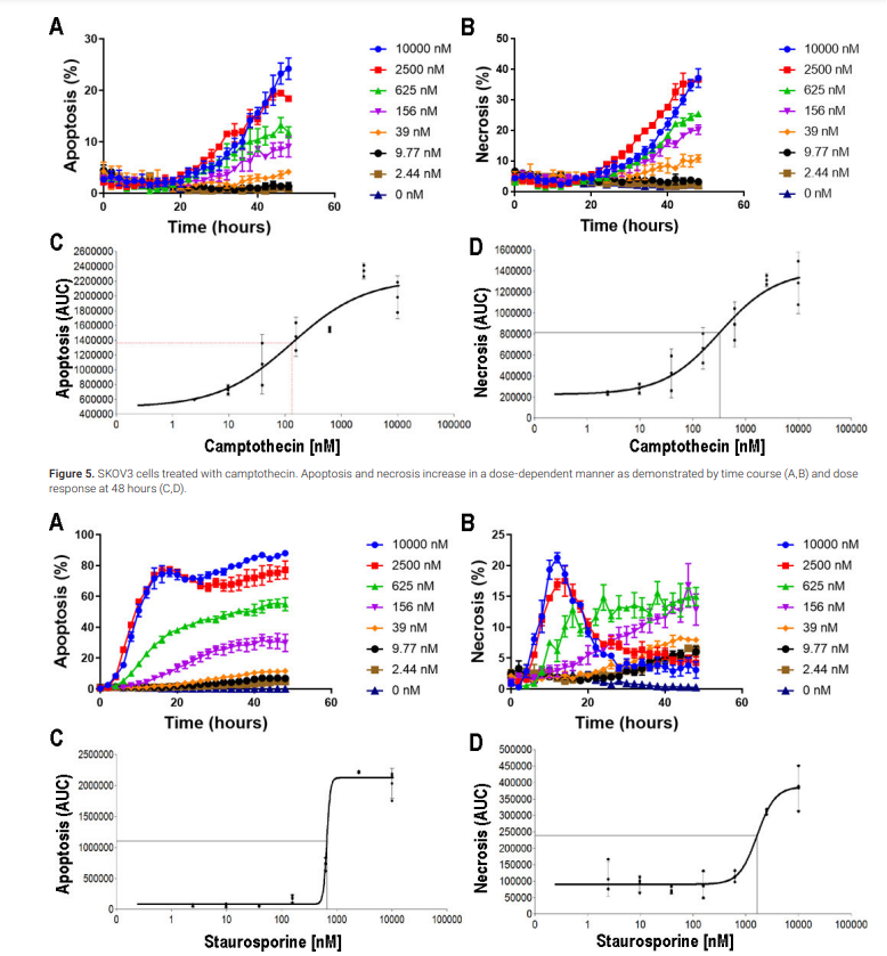 Figura 6. Células HT-1080 tratadas con estaurosporina. La apoptosis y la necrosis aumentan de manera dependiente de la dosis, como lo demuestra el curso temporal (A,B) y la dosis respuesta a niveles máximos de muerte celular a las 16 (C) y 12 (D) horas.
Figura 6. Células HT-1080 tratadas con estaurosporina. La apoptosis y la necrosis aumentan de manera dependiente de la dosis, como lo demuestra el curso temporal (A,B) y la dosis respuesta a niveles máximos de muerte celular a las 16 (C) y 12 (D) horas.
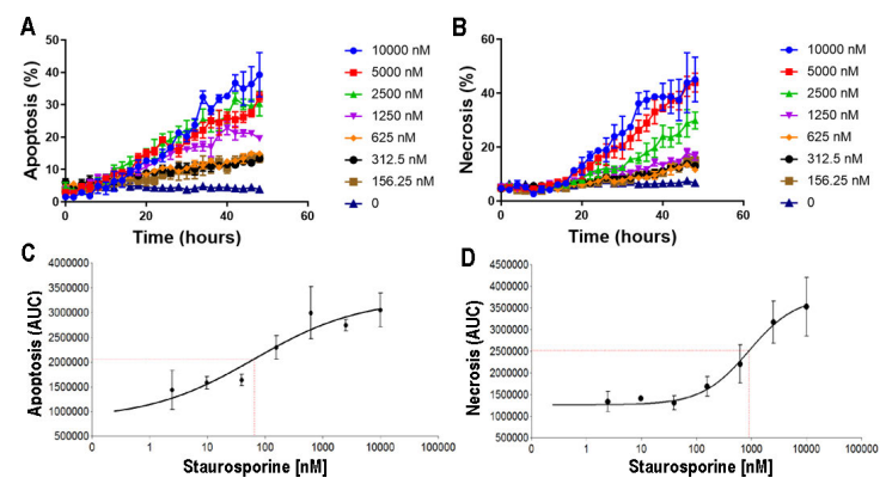 Figura 7. Células SKOV3 tratadas con estaurosporina. La apoptosis y la necrosis aumentan de manera dependiente de la dosis, como lo demuestra el curso temporal (A,B) y la dosis respuesta a las 48 horas (C,D).
Figura 7. Células SKOV3 tratadas con estaurosporina. La apoptosis y la necrosis aumentan de manera dependiente de la dosis, como lo demuestra el curso temporal (A,B) y la dosis respuesta a las 48 horas (C,D).
Conclusión
El uso de sondas fluorescentes de apoptosis y necrosis en combinación con imágenes cinéticas automatizadas permite la evaluación cuantitativa de los efectos de inductores conocidos de muerte celular en múltiples líneas celulares. Este ensayo utiliza imágenes de campo claro sin etiquetas de alto contraste para analizar el número total de células y tintes celulares para etiquetar tanto las células apoptóticas como las necróticas al mismo tiempo. Esto permite la determinación del porcentaje de apoptosis y necrosis en cada población celular durante un tratamiento farmacológico a largo plazo sin el uso de un colorante nuclear. Cuando las células HT-1080 o SKOV3 se tratan con diluciones de camptotecina o estaurosporina, la apoptosis y la necrosis se inducen de manera dependiente de la dosis a lo largo del tiempo. Este ensayo también demuestra la respuesta diferente de diferentes células al mismo estímulo, como en el caso de SKOV3 y HT-1080 que responden de manera diferente a la camptotecina. El análisis cinético de la muerte celular permite una determinación sensible y en tiempo real de la acumulación de eventos apoptóticos y necróticos dentro de la población celular.
Referencias
- Elmore, S. Apoptosis: una revisión de células programadas Muerte. Toxicol. Patol. 2007, 35, 495–516.
- Fink, S. L. & Cookson, B. T. Apoptosis, Pyroptosis, and Necrosis: descripción mecanicista de muertos y moribundos Células eucariotas. Infectar. inmune 2005, 73, 1907–16.
- Clayton, J. Kinetic Proliferation Assay usando Label-Free Conteo de células, 2017.
- Venditto, V. J. & Simanek, E. E. Terapias contra el cáncer que utilizan las camptotecinas: una revisión de la literatura in vivo.mol. Farmacia 2010, 7, 307–49.
- Morimoto, H., Safrit, J. T. & Bonavida, B. Synergistic Efecto del Factor de Necrosis Tumoral-Alfa- y Difteria Citotoxicidad mediada por toxinas en sensibles y resistentes Líneas celulares de tumores de ovario humano. J. Immunol. 1991, 147, 2609–16.
- Tamaoki, T. et al. Estaurosporina, un potente inhibidor de Proteína Quinasa Dependiente de Fosfolípidos/Ca++. Bioquímica Biografía. Res. común 1986, 135, 397–402.
Ver paper completo original en: https://www.summit-research.com.ar/wp-content/uploads/2022/10/live-cell-imaging-apoptosis-necrosis-5994-2685EN-agilent.pdf