Los ácidos nucleicos aislados de una variedad de tipos de muestras proporcionan el material de partida para una amplia gama de aplicaciones posteriores. La cuantificación del ácido nucleico aislado es necesaria antes de la introducción en estas aplicaciones. El espectrofotómetro Epoch proporciona un medio para obtener mediciones precisas en una amplia gama de concentraciones y volúmenes de muestras, incluida la cuantificación de microvolúmenes. La comparación con otros dispositivos dedicados de microvolumen, como NanoDrop, muestra un rendimiento equivalente.
Introducción
El aislamiento de ADN y ARN de una amplia gama de muestras proporciona el material de partida para una gran variedad de aplicaciones. Las muestras comunes son:
- tejidos de diversos orígenes, incluidas biopsias humanas, modelos animales, secciones fijadas en formalina e incluidas en parafina
- fluidos corporales incluyendo sangre e hisopos bucales
- células eucariotas y bacterianas
Luego, el ácido nucleico aislado se puede usar para aplicaciones posteriores. Como las que se ilustran al final de los flujos de trabajo analíticos en la Figura 1.
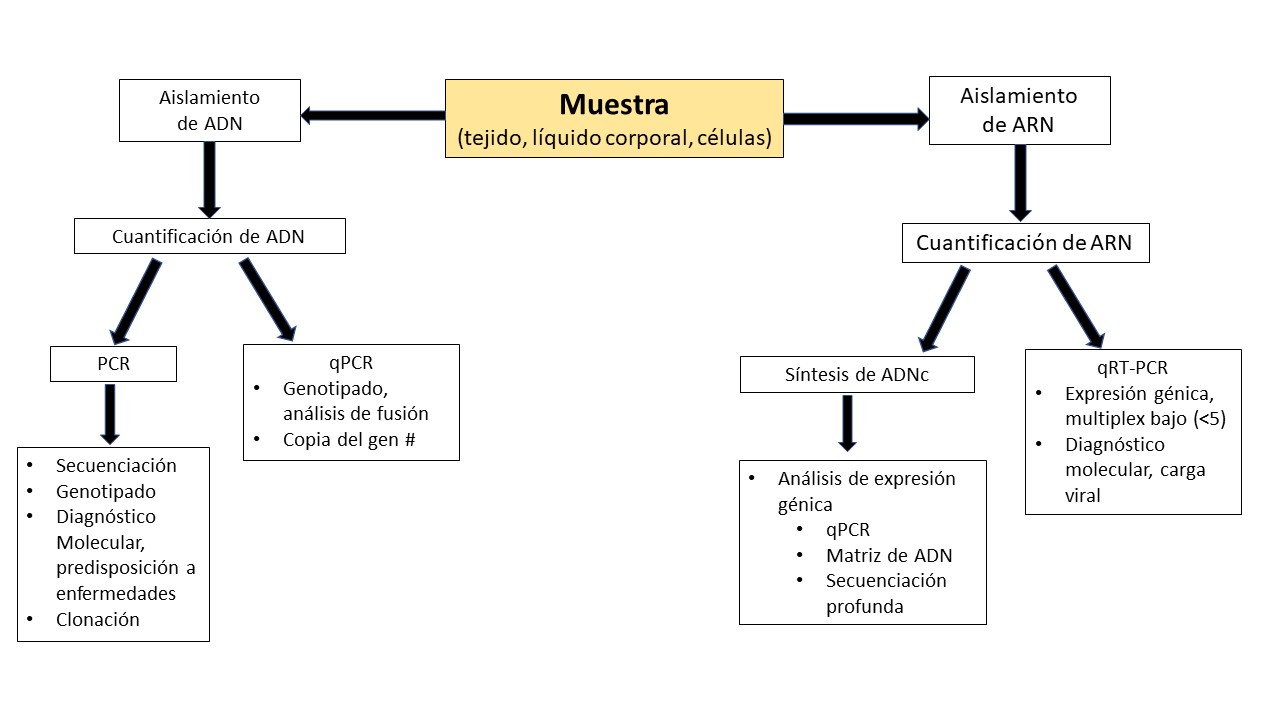 Figura 1. Flujos de trabajo genómicos para aplicaciones posteriores de ADN y ARN
Figura 1. Flujos de trabajo genómicos para aplicaciones posteriores de ADN y ARN
Esencialmente, las aplicaciones basadas en el ADN implican la secuenciación, el genotipado, la determinación del número de copias de genes y la clonación.
Para el ARN, el objetivo es el análisis de la expresión génica. Esto se puede hacer directamente a partir del ARN usando transcriptasa inversa además de la polimerasa en un experimento de RT-PCR cuantitativa de un solo paso. O se puede hacer una biblioteca de ADNc a partir del ARNm aislado. La ventaja de este último es la estabilidad del ADN en relación con el ARN. Este cDNA se puede usar para PCR cuantitativa para multiplexación simple o baja de genes expresados, usando micromatrices de ADN para multiplexación extremadamente alta, o incluso análisis de transcriptoma completo mediante métodos de secuenciación profunda.
La cuantificación de ADN y ARN al principio de los flujos de trabajo representados en la Figura 1 es necesaria para garantizar que las cantidades relativas de plantilla de ácido nucleico (es decir, la porción del ADN o ARN aislado que se amplificará y analizará) y otros reactivos, como enzimas y los nucleótidos libres utilizados para la amplificación (es decir, en PCR o RT-PCR) son adecuados para reacciones eficaces.
Cuantificación de Biomoléculas por Espectroscopía UV
Los métodos estándar de cuantificación de ácidos nucleicos posteriores al aislamiento incluyen la absorción espectrofotométrica y la fluorescencia, cuando los ácidos nucleicos se quelan con un colorante de unión. El método más común sigue siendo la espectroscopia de absorción debido a la absorción máxima de ADN y ARN a 260 nm1. Brevemente, una solución del ácido nucleico a analizar se coloca dentro de un recipiente y se carga en un espectrofotómetro y se somete a luz incidente a una longitud de onda e intensidad (Io) predeterminadas. La absorción de la luz ultravioleta se mide a medida que pasa a través de la muestra midiendo la intensidad (I) en un fotodetector.
La cantidad de luz absorbida está directamente relacionada con la concentración de la muestra, la longitud de la trayectoria y el coeficiente de extinción de la biomolécula de interés. La Ley de BeerLambert relaciona la absorción de luz y la concentración de la molécula absorbente a través de la siguiente ecuación donde A = log Io/I = εlc. ε se refiere al coeficiente de extinción del analito (εdsDNA = 50 ng-cm µL-1; εRNA = 40 ng-cm/µL), l es el paso óptico (cm) y c es la concentración del analito (ng/µL) , como se ilustra en la Figura 2.
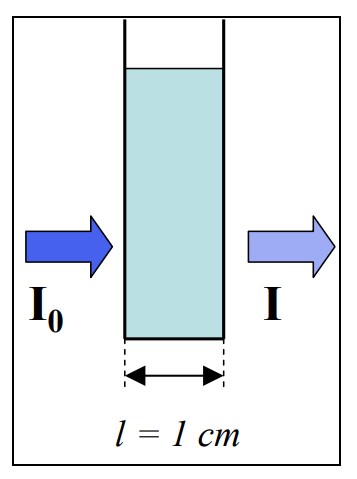
Figura 2. La cuantificación de biomoléculas por espectroscopia UV depende de la absorbancia de la luz a medida que pasa a través de la muestra. La relación se describe mediante la Ley de Beer-Lambert A= εlc
Instrumentación basada en cubetas y microplacas
Los espectrofotómetros basados en cubetas son el instrumento gold-standard para realizar determinaciones espectrofotométricas de ácidos nucleicos. La exactitud y precisión en la cuantificación de ácidos nucleicos nativos a 260 nm utilizando cubetas estándar de 1 cm de paso óptico no tiene comparación con otros instrumentos y métodos. Sin embargo, el espectrofotómetro basado en cubetas no se presta para replicar las mediciones de muchas muestras. Después de cada análisis, la cubeta debe vaciarse, lavarse y recargarse con muestra nueva. Esto es muy oneroso si es necesario cuantificar numerosas muestras.
Protocolos
Para remediar esta situación, los laboratorios han adoptado protocolos que utilizan un formato basado en microplacas de 96 o 384 pocillos. Así como instrumentación adecuada para microplacas compatible con espectrofotometría de absorción UV. Tradicionalmente, las mediciones basadas en cubetas se realizan en un lector que usa fotometría horizontal posicionada a 90 grados de la cubeta, lo que da como resultado una longitud de trayectoria fija. La instrumentación basada en microplacas utiliza fotometría vertical en la que la longitud de la trayectoria resultante se debe a la altura del volumen de la muestra en un pocillo de la microplaca a través del cual se lee la muestra. El resultado es una longitud de trayectoria variable que depende del volumen de la muestra y de las dimensiones del pocillo de la microplaca (Figura 3).
Las longitudes de trayectoria se pueden corregir en los pocillos de las microplacas aprovechando un pico pequeño pero significativo en la absorbancia del agua a 977 nm. Usando este fenómeno, la longitud del camino de cualquier solución acuosa en un pocillo de microplaca se puede determinar comparando la absorbancia de esa solución en un camino conocido (p. ej., 1 cm) con la absorbancia en el pocillo de la microplaca. La relación entre la determinación de la absorbancia del pocillo de la microplaca y la determinación de 1 cm es igual al paso óptico en centímetros. La absorbancia de la longitud de onda experimental dividida por el paso óptico da como resultado una absorbancia corregida a 1 cm2.
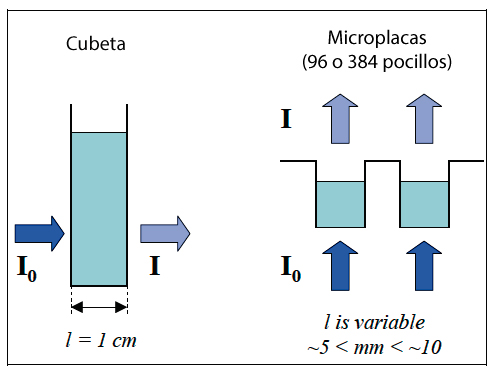
Figura 3. Paso óptico fijo usando una cubeta orientada verticalmente (l = 1 cm) y paso óptico variable obtenido usando microplacas. La longitud del camino depende del volumen de la muestra y de las dimensiones del pocillo de la microplaca.
Instrumentación de microvolúmenes
Hay cubetas de microvolumen disponibles que permiten el análisis de muestras en el rango de microlitros con longitudes de trayectoria fijas, una fracción de la disponible con cubetas estándar. La principal ventaja de estas cubetas de microvolumen es que las muestras de ácido nucleico no tienen que diluirse para cuantificarlas con precisión, ya que la densidad óptica de la medición se reduce en el mismo factor que la reducción del paso óptico. Estos también tienen la ventaja de ser utilizados con espectrofotómetros de cubeta convencionales. Sin embargo, las cubetas de microvolumen tienen la misma desventaja que las cubetas estándar cuando se trata de múltiples muestras y, a menudo, son difíciles de limpiar.
Un dispositivo popular para realizar la cuantificación de microvolúmenes de ácidos nucleicos es NanoDrop de Thermo Scientific. Hay varios modelos, pero el más común en los laboratorios es el modelo de un solo canal. NanoDrop utiliza una tecnología única de retención de muestras para crear un camino óptico uniforme y muy corto, lo que permite el análisis sin necesidad de dilución. También hay disponibles en el mercado otros dispositivos similares de bajo volumen de un solo canal.
Espectrofotómetro Epoch™ para análisis de varios volúmenes
El sistema de espectrofotómetro Epoch™ es la solución de BioTek para los investigadores que requieren una capacidad de cuantificación de ácido nucleico de volumen bajo o micro. Este sistema incluye un lector de microplacas UV-V.s basado en monocromador y una placa multivolumen Take3™. La placa Take3 de BioTek proporciona un medio para realizar la cuantificación de microvolúmenes en múltiples muestras, así como mediciones de 1 cm con una cubeta estándar o BioCell, una cubeta diseñada por BioTek.
La Placa Take 3
La placa Take3 permite la cuantificación de hasta dieciséis muestras de 2 µL con un paso óptico nominal de 0,5 mm para el análisis de microvolúmenes.
La longitud de ruta más corta permite la medición directa de muestras altamente concentradas que suelen producir muchos kits preparativos de bajo volumen, como los mini kits AllPrep DNA/RNA de Qiagen.
Además, sin embargo, se puede medir una amplia gama de concentraciones y volúmenes utilizando la placa Take3 con su capacidad para acomodar cubetas o BioCells en la placa además de las ubicaciones de micropuntos (Figura 4). Para realizar las mediciones se utiliza el espectrofotómetro de microplacas Epoch.


Figura 4. La placa Take3 ofrece varias opciones para medir muestras: A) 16 ubicaciones de micropuntos para carga de muestra de 2 µl para análisis de microvolúmenes. B) la placa puede acomodar dos BioCells y una cubeta estándar (cada una de 1 cm de paso óptico).
Además, el espectrofotómetro de microplacas Epoch puede medir la absorbancia de muestras en microplacas con densidades que oscilan entre 6 y 384 pocillos para una amplia gama de aplicaciones, incluidos los ELISA (Figura 5).
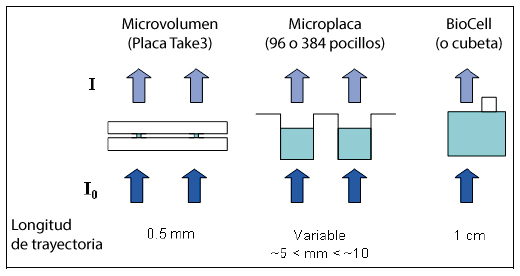
Figura 5. Análisis de varios volúmenes con el sistema de espectrofotómetro Epoch™Methods
Para probar la aplicabilidad del sistema de espectrofotómetro Epoch para proporcionar una cuantificación precisa de una variedad de tipos de muestras, volúmenes y concentraciones, se aisló el ADN y el ARN totales de células de ovario de hámster chino (CHO-M1) del cultivo. Luego, las muestras purificadas se cuantificaron con el sistema de espectrofotómetro Epoch utilizando muestras sin diluir en ubicaciones de micropuntos en la placa Take3 o después de la dilución para muestras concentradas en un BioCell y microplacas de 96 pocillos. Se realizaron mediciones adicionales en el NanoDrop 2000c (Thermo Scientific) para comparar.
Resultados del análisis con el espectrofotómetro Epoch
Se determinó que el dsDNA derivado de ~ 3 X 106 células CHO-M1 tenía una concentración de ~ 440 ng/μL según todas las mediciones con diferentes métodos/instrumentación (consulte la Figura 8). La muestra se eluyó de la columna AllPrep en un volumen total de ~300 µl de tampón de elución para obtener un rendimiento total de aproximadamente 129 µg dsDNA, con una relación A260/280 de ~1,9, lo que indica una preparación de muestra altamente purificada. La cuantificación fue muy consistente en todos los volúmenes probados, donde las precisiones se ubicaron dentro del 2 % de la medición de BioCell (Figura 6).
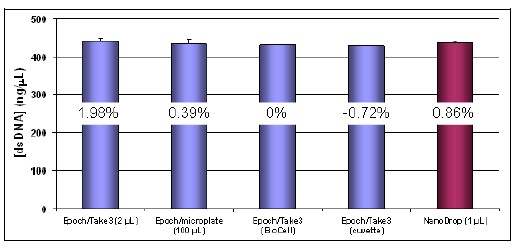 Figura 6. Cuantificación de dsDNA a partir de la capacidad de varios volúmenes del sistema de espectrofotómetro Epoch y comparación con NanoDrop. Los porcentajes ilustrados en las columnas del gráfico de barras reflejan el % de diferencia de la medición con respecto a una medición de 1 cm de longitud de trayectoria realizada con BioCell en la placa Take3.
Figura 6. Cuantificación de dsDNA a partir de la capacidad de varios volúmenes del sistema de espectrofotómetro Epoch y comparación con NanoDrop. Los porcentajes ilustrados en las columnas del gráfico de barras reflejan el % de diferencia de la medición con respecto a una medición de 1 cm de longitud de trayectoria realizada con BioCell en la placa Take3.
El rendimiento de ARN fue de aproximadamente 1800 ng/μl en un volumen total de 150 μl para un total de aproximadamente 270 μg de ARN con una relación A260/280 de ~2,0. Nuevamente indicativo de una preparación de muestras de buena calidad (Figura 10). Se encontró nuevamente que la cuantificación era consistente en todos los volúmenes probados, donde las precisiones cayeron dentro de ~ ± 2.5% con las mayores desviaciones derivadas de las mediciones tomadas en el formato de microplaca (Figura 7).
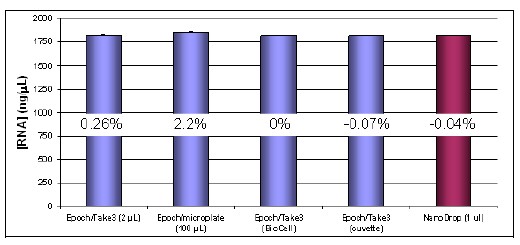
Figura 7. Cuantificación de ARN a partir de la capacidad de varios volúmenes del sistema de espectrofotómetro Epoch y comparación con NanoDrop. Los porcentajes ilustrados en las columnas del gráfico de barras reflejan el % de diferencia de la medición con respecto a una medición de 1 cm de longitud de trayectoria realizada con BioCell en la placa Take3.
Conclusión del análisis con el espectrofotómetro Epoch
La cuantificación de ácidos nucleicos después del aislamiento de muestras biológicas es un procedimiento estándar para muchas aplicaciones. El espectrofotómetro de microplacas Epoch, utilizado con la placa Take3, constituye un sistema que puede proporcionar una cuantificación precisa a partir de microvolúmenes, microplacas y cubetas de 1 cm de paso óptico y BioCell. La cuantificación de microvolúmenes utilizando los micropuntos de la placa Take3 evita la necesidad de diluir las muestras de ácido nucleico aisladas. Se pueden cuantificar hasta 16 muestras al mismo tiempo con la placa Take3. Las comparaciones con mediciones de paso óptico de 1 cm y con NanoDrop demuestran una equivalencia en el rendimiento analítico.
Referencias
- Sambrook and Russell. Molecular Cloning: A Laboratory Manual (3rd Ed.). Cold Spring Harbor Laboratory Press. 2001.
- Held. “Nucleic Acid & Protein in the Microplate Format” CHIMIA 2001, vol.55, issue 1-2, p. 40-42.
Nota: Solo para uso de investigación. No debe utilizarse en procedimientos de diagnóstico

